Non tutti i prodotti, i servizi o le funzionalità dei prodotti e dei servizi sono disponibili in tutte le aree. Rivolgersi al proprio rappresentante locale.BD
Indicazioni
L’innesto chirurgico XenMatrix™ è destinato all’impianto per il rinforzo di difetti dei tessuti molli dovuti a indebolimento da ernie addominali e incisionali.
Controindicazioni
L’impianto biologico XENMATRIX™ non deve essere usato in pazienti con sensibilità nota ai prodotti di origine suina.
Non adatto alla ricostruzione di difetti cardiovascolari.
Non adatto alla ricostruzione di difetti del sistema nervoso centrale o periferico.
L’uso di questo prodotto in applicazioni diverse da quelle indicate può causare complicanze gravi.
Avvertenze
Questo dispositivo è esclusivamente monouso. Il riutilizzo, il ritrattamento, la risterilizzazione o il riconfezionamento possono compromettere l’integrità strutturale e/o le caratteristiche essenziali dei materiali e del design, indispensabili per garantire le prestazioni complessive del dispositivo, e possono determinare un malfunzionamento del dispositivo, con possibile danno al paziente. Il riutilizzo, il ritrattamento, la risterilizzazione o il riconfezionamento possono anche creare un rischio di contaminazione del dispositivo e/o causare un’infezione al paziente o un’infezione crociata, comprendente, senza limitazioni, la trasmissione di malattie infettive da un paziente ad un altro. La contaminazione del dispositivo può portare a danno, malattia o decesso del paziente o dell’utilizzatore finale.
Il prodotto è fornito sterile. Prima dell’uso, esaminare con attenzione la confezione e il prodotto per verificare l’assenza di danni e che tutti i sigilli siano intatti. Non utilizzare se la confezione è aperta o danneggiata oppure se l’indicatore di temperatura sul sacchetto di alluminio è nero.
Non risterilizzare.
Se si sviluppa un’infezione, deve essere trattata in modo aggressivo.
Una reazione allergica, non correlata ad altre terapie, è un’indicazione per la valutazione della rimozione dell’impianto biologico XENMATRIX™.
Dopo l’uso, i componenti non utilizzati e la confezione devono essere trattati come potenzialmente pericolosi dal punto di vista biologico. Maneggiarli ed eliminarli secondo la pratica medica accettata e secondo le leggi e le norme locali, regionali e nazionali applicabili.
La sicurezza e l’efficacia dell’innesto chirurgico XenMatrix™ non sono state valutate o definite nell’ambito delle applicazioni riportate di seguito: Donne in gravidanza o in allattamento & Uso pediatrico.
Precauzioni
Leggere tutte le istruzioni prima dell’uso.
L’impianto biologico deve essere utilizzato solo da medici qualificati, addestrati alle appropriate tecniche chirurgiche.
È necessario seguire una tecnica rigorosamente asettica.
Il chirurgo deve conoscere in modo approfondito la procedura chirurgica e le caratteristiche delle prestazioni dell’impianto biologico.
Posizionare il dispositivo il più possibile a contatto con il tessuto sano, ben vascolarizzato, per promuovere la crescita interna delle cellule e il rimodellamento del tessuto.
Quando non è possibile un avvicinamento dei margini cutanei tale da ricoprire l’impianto XENMATRIX™, occorre far sì che lo stesso rimanga umido. Evitare che “dispositivi a suzione continua” asciughino l’impianto, per non comprometterne le prestazioni.
Reazioni avverse
Le possibili complicanze correlate all’uso di una qualsiasi protesi possono includere, senza limitazione, allergia, sieroma, infezione, infiammazione, aderenze, formazione di fistole, ematomi e recidive dell’ernia o del difetto tissutale.
Bibliografia
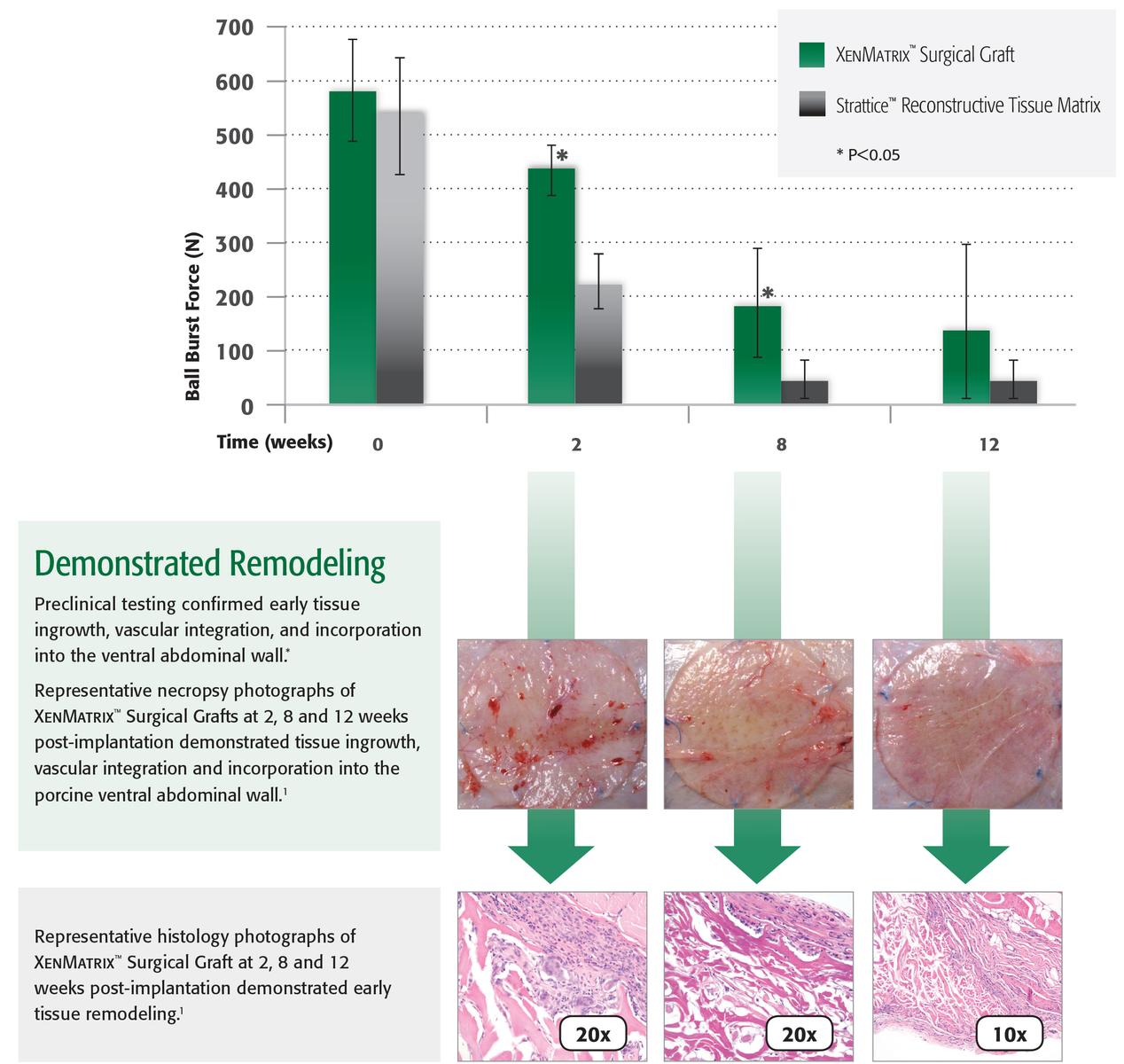
- Dati preclinici in archivio; i risultati potrebbero non corrispondere alle prestazioni cliniche.
- Deeken CR, Eliason B, Pichert M, Grant S, Frisella M, Matthews B. Differentiation of Biologic Scaffold Materials Through Physiomechanical, Thermal and Enzymatic Degradation Techniques. Ann Surg 2012. Mar; 255(3):595-604.