Sigillante chirurgico Progel™ Platinum
Un'opzione unica progettata per risolvere le complicanze post-operatorie da perdita d'aria.

- Panoramica
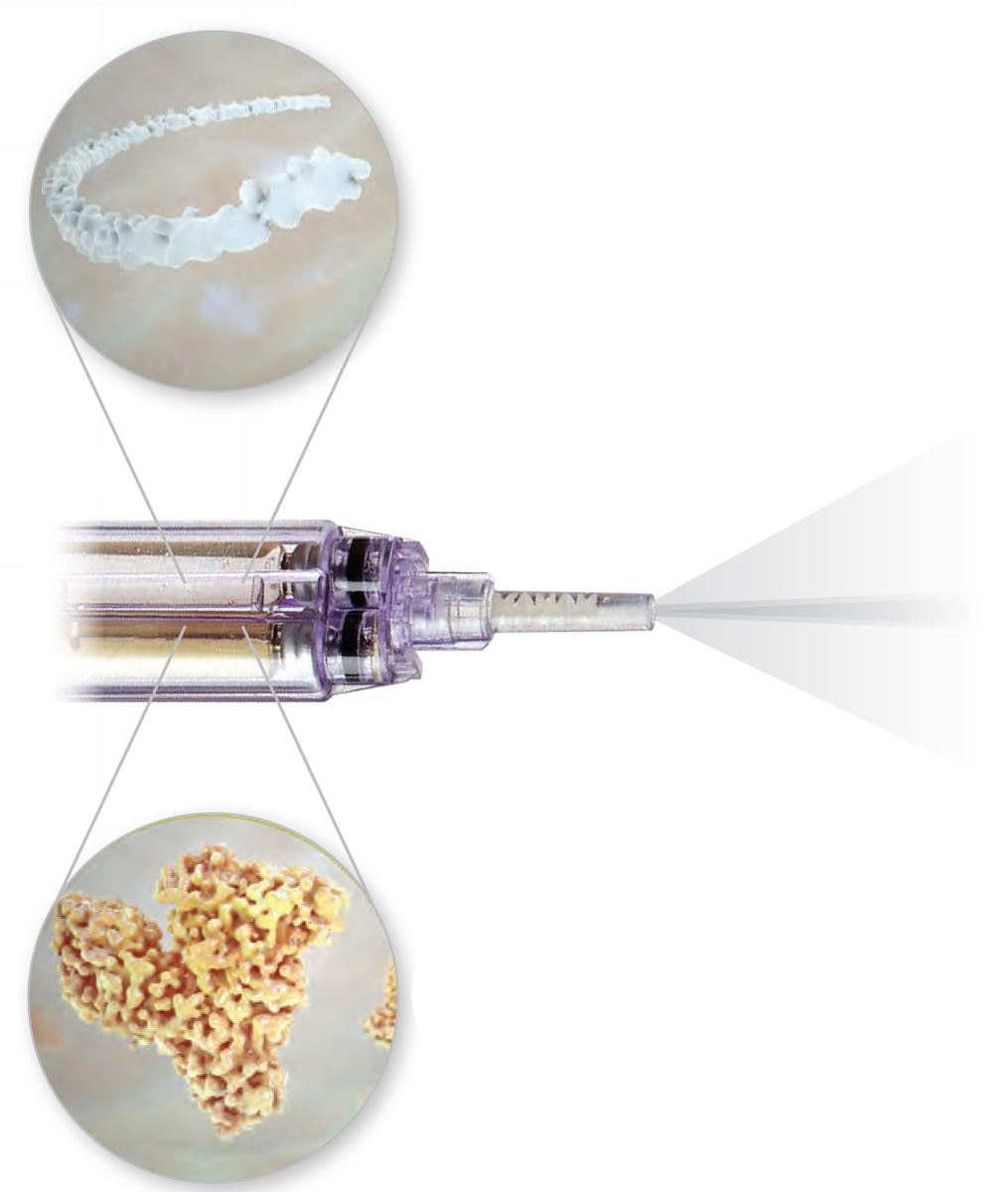
Progettato
- L'unico sigillante appositamente progettato per il polmone e le sue caratteristiche uniche
- Combina glicole polietilenico (PEG) e albumina umana ricombinante (rHA) per formare un idrogel flessibile
- Gelifica in corrispondenza del tessuto, legandosi direttamente al polmone per un'aderenza ottimale e una tenuta ermetica
Progettato
- Con una forza in grado di resistere alla riespansione del polmone entro 2 minuti dall'applicazione1
- Altamente elastico per consentire al polmone di espandersi e contrarsi naturalmente durante la respirazione
- La punta brevettata di Progel™ Platinum Extended consente un'applicazione personalizzata da un unico dispositivo facile da usare
Indicato
- Il sigillante chirurgico Progel™ Platinum è l'unico sigillante approvato in Europa specificamente per sigillare le perdite d'aria pleuriche.
- Progel™ Platinum forma un idrogel altamente flessibile specificamente progettato per l'uso sul polmone.
- Il sigillante chirurgico Progel™ Platinum è l'unico prodotto approvato dalla FDA per trattare le perdite d'aria, indipendentemente dall'approccio.2
Clinicamente provato
- L'unico sigillante clinicamente comprovato per trattare efficacemente le complicanze da perdita d'aria nella chirurgia toracica sia aperta che minimamente invasiva.1
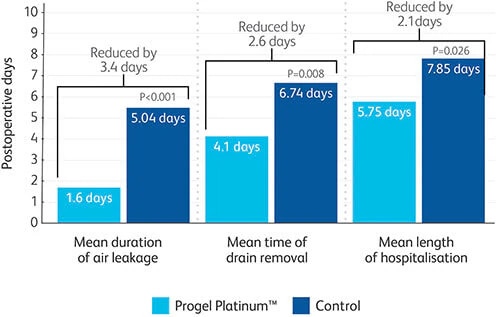
- In uno studio prospettico, randomizzato e multicentrico, è stato dimostrato che sigilla le perdite e riduce la durata della degenza ospedaliera di 2,1 giorni.3
Prezzo contenuto
- Il 58% dei pazienti sottoposti a chirurgia polmonare presenta una perdita d'aria in sala operatoria.3
- Le perdite d'aria sono il fattore determinante più importante nella durata della degenza ospedaliera (LOS): una perdita d'aria prolungata può allungare la durata della degenza di oltre 4 giorni.5
- Il costo totale del trattamento delle perdite d'aria postoperatorie prolungate e delle complicanze cliniche ad esse associate è notevole.6
- Il costo totale postoperatorio a 90 giorni di una perdita d'aria prolungata è stimato in ulteriori 5000 € per paziente.7
- È stato dimostrato che il sigillante chirurgico Progel™ Platinum è in grado di sigillare efficacemente le perdite d'aria durante la chirurgia polmonare, riducendo la durata dell'ospedalizzazione di 2,1 giorni in media, minimizzando potenzialmente le complicanze associate e i costi dell'assistenza.8
This is a modal window.
Beginning of dialog window. Escape will cancel and close the window.
End of dialog window.
This is a modal window. This modal can be closed by pressing the Escape key or activating the close button.
Animazione Progel PlatinumTM MOA
This is a modal window.
Beginning of dialog window. Escape will cancel and close the window.
End of dialog window.
This is a modal window. This modal can be closed by pressing the Escape key or activating the close button.
Sigillante chirurgico Progel PlatinumTM
Non tutti i prodotti, i servizi o le funzionalità dei prodotti e dei servizi sono disponibili in tutte le aree. Rivolgersi al proprio rappresentante BD locale.
USO PREVISTO/INDICAZIONI PER L’USO
Il sigillante chirurgico PROGEL PLATINUM™ è un dispositivo monouso indicato per sigillare le perdite di aria visibili sulla pleura viscerale dopo l’impiego di tecniche standard di chiusura della pleura viscerale durante la resezione del parenchima polmonare.
CONTROINDICAZIONI
Non usare PROGEL PLATINUM™ in pazienti con precedenti di reazioni allergiche al lievito, all’albumina umana ricombinante o ad altri componenti del dispositivo.
Non usare PROGEL PLATINUM™ in pazienti che potrebbero essere affetti da capacità renale insuffi ciente per l’eliminazione del carico di polietilenglicole di PROGEL PLATINUM™.
Non applicare PROGEL PLATINUM™ su difetti aperti o chiusi dei bronchi principali o dei bronchi lobari a causa di un possibile aumento dell’incidenza di fi stole bronco-pleuriche, inclusi i pazienti sottoposti a neumonectomia, resezione a manicotto o broncoplastica.
Non applicare PROGEL PLATINUM™ su cellulosa rigenerata ossidata, spugne in gelatina assorbibile o altre superfi ci diverse dalla pleura viscerale, poiché l’aderenza e il risultato atteso potrebbero essere ompromessi.
Non usare più di 30 ml di PROGEL PLATINUM™ per paziente
AVVERTENZE
Utilizzare PROGEL PLATINUM™ esclusivamente come descritto nelle presenti Istruzioni per l’uso. Conservare sempre PROGEL PLATINUM™ a una temperatura compresa tra 2 °C e 25 °C. Non congelare. La mancata conservazione di PROGEL PLATINUM™ nell’intervallo di temperatura consigliato può determinare uno scadimento delle prestazioni del prodotto. Esaminare le confezioni prima dell’apertura. Per non compromettere le restazioni e la sterilità di PROGEL PLATINUM™ non utilizzarlo dopo la data di scadenza. Se l’integrità della confezione e/o del prodotto sono state compromesse (ad es., sigillo della confezione danneggiato o vetro otto), non usare né risterilizzare il contenuto. Il dispositivo è fornito in confezione sterile ed è esclusivamente monouso. Non risterilizzarlo né ricondizionarlo. Se si riutilizza o si ricondiziona il dispositivo, è possibile omprometterne l’integrità strutturale e/o provocare il guasto del dispositivo che, a sua volta, può comportare lesioni, malattia o morte del paziente. Inoltre, il ricondizionamento di dispositivi monouso può comportare il rischio di contaminazione e/o infezione o infezione crociata, compresa, tra l’altro, la trasmissione di malattie infettive da un paziente all’altro. La contaminazione del dispositivo può causare lesioni, malattia o morte del paziente. Fare riferimento alle altre ‘precauzioni’ in queste Istruzioni per l’uso.
PRECAUZIONI
La sicurezza e l’efficacia di PROGEL PLATINUM™ non sono state stabilite in pazienti con le seguenti condizioni:
Età inferiore a 18 anni, donne incinte o in allattamento.
Casi di resezione polmonare contaminata o “sporca”.
Presenza di un’infezione attiva.
In presenza di altri sigillanti, dispositivi emostatici o prodotti diversi da suture e graffe utilizzate nella chiusura standard della pleura viscerale.
Perdite di aria dalla pleura viscerale causate da pneumotorace spontaneo, traumi ai tessuti polmonari non dovuti a resezione, malignità, nonché difetto funzionale o anatomico congenito o acquisito.
Su zone o tessuti diversi dalla superficie della pleura viscerale come indicato.
Ispezionare la confezione sterile e il sigillo prima dell’uso. Non utilizzare se la confezione sterile o il sigillo sono aperti o danneggiati.
Non usare crosslinker reidratato dopo 20 minuti, in quanto ciò può compromettere le prestazioni di PROGEL PLATINUM™.
L’interruzione dell’applicazione per circa 10 secondi può provocare l’occlusione della punta spray. Se si verifica un’occlusione, rimuovere la punta spray, pulire l’estremità dell’applicatore per rimuovere eventuale liquido presente e collegare una nuova punta spray (fornita) all’estremità dell’applicatore. PROGEL PLATINUM™ è esclusivamente monouso. Non risterilizzare né riutilizzare alcun componente. La risterilizzazione o il riutilizzo di PROGEL PLATINUM™ può causare la perdita delle prestazioni funzionali del prodotto.
Durante l’applicazione di PROGEL PLATINUM™, interrompere se possibile la ventilazione del polmone da sottoporre a trattamento al fine di ridurre le perdite di aria dai siti target e ridurre al minimo il ovimento dei tessuti durante l’applicazione di PROGEL PLATINUM™. Se il paziente ha bisogno di ventilazione polmonare, si consiglia di diminuire il volume corrente.
Durante la preparazione e tra un’erogazione e l’altra, passare sulla punta dell’applicatore una garza sterile e pulita per asportare eventuale liquido espulso con l’aria. Evitare di mescolare i componenti: non strofinare dall’apertura di una cartuccia all’altra – pulire separatamente ciascuna apertura.
Il design esclusivo della punta spray consente l’applicazione di PROGEL PLATINUM™ come spray o come getto (una pressione decisa e costante sull’asta di spinta eroga uno spray, mentre una pressione lieve roga un getto).
Durante l’applicazione di PROGEL PLATINUM™, tenere la punta dell’applicatore a circa 5 cm dall’area del trattamento per evitare la formazione di bolle nel materiale di PROGELPLATINUM™. Le bolle possono compromettere l’aderenza e/o le proprietà meccaniche di PROGEL PLATINUM™.
Smaltire il materiale inutilizzato in conformità alle normali procedure relative ai componenti di PROGEL PLATINUM™.
L’albumina umana ricombinante (rHA) presente nel kit PROGEL PLATINUM™ è un derivato del lievito e non contiene alcun ingrediente di origine umana o animale. L’rHA è equivalente all’albumina sierica mana, pur non derivando da sangue umano.
Durante il montaggio dell’applicatore, l’asta di spinta di PROGEL PLATINUM™ deve bloccarsi nell’alloggiamento dell’applicatore. La rimozione forzata dell’asta di spintadi bloccaggio dall’alloggiamento dell’applicatore può potenzialmente causare danni al sistema dell’applicatore o alle cartucce chimiche.
L’utilizzo di PROGEL PLATINUM™ con additivi (ad es. antibiotici) a qualsiasi componente non è stato studiato.
EVENTI AVVERSI (EA)
Come nel caso di qualsiasi dispositivo medico utilizzato in una procedura chirurgica, sono sempre possibili eventi avversi (EA). L’elenco seguente riporta i possibili EA associati a interventi chirurgici polmonari.
Febbre, Infezione
Fibrillazione atriale, Anomalie della funzione renale
Nausea, Ipertensione
Pneumotorace, Enfisema
Anemia, Dolore
Morte, Polmonite
Cardiopatie, Embolia
Effusione pleurica, Problemi urinari
Insufficienza renale acuta, Collasso respiratorio
Aritmia, Sintomi parainfluenzali
Sanguinamento, Emorragia
Insufficienza cardiaca, Insufficienza respiratoria
Edema, Ematoma in corrispondenza del sito
Reazione allergica, Reflusso gastroesofageo
Dispnea, Distress respiratorio
Riferimenti
- Istruzioni per l'uso del sigillante chirurgico Progel™ Platinum. M-00351. Dati in archivio.
- Il sigillante chirurgico Pogel™ Pleural (PALS) non è disponibile nell'UE; l'unica differenza con Progel™ Platinum è che quest'ultimo è composto da una combinazione brevettata di albumina umana ricombinante (rHA), mentre il componente principale del PALS è la sieroalbumina umana (HSA).
- Allen, Mark S. et al, “Prospective Randomized Study Evaluating a Biodegradable Polymeric Sealant for Sealing Intraoperative Air Leaks That Occur During Pulmonary Resection” Annals of Thoracic Surgery 2004; 77:1792-1801. Studio cardine. Dati in archivio.
- Brunelli et al. Predictors of prolonged air leak after pulmonary lobectomy. Ann Thorac Surg 2004; 77: 1205-1210. Sulla base dell'incidenza riportata di perdite d'aria post-operatorie prolungate. Dati in archivio.
- Mueller MR, Marzluf BA. The anticipation and management of air leaks and residual spaces post lung resection. J Thorac Dis. 2014 Mar;6(3):271-84. Dati in archivio.
- Varela G. et al. Estimating hospital costs attributable to prolonged air leak in pulmonary lobectomy. Eur J Cardiothorac Surg. 2005 Feb;27(2):329-33.
- Brunelli A et al. Ninety-day hospital costs associated with prolonged air leak following lung resection. Interact Cardiovasc Thorac Surg. 2020 Oct 1;31(4):507-512.
- Zaraca F. et al. Cost-effectiveness analysis of sealant impact in management of moderate intraoperative alveolar air leaks during video-assisted thoracoscopic surgery lobectomy: a multicentre randomised controlled trial. J Thorac Dis. 2017 Dec;9(12):5230-5238)
BD-54055