El sistema de posicionamiento Echo PS™ es un balón de perfil bajo preacoplado a la malla Ventralight™ ST. Una vez hinchado, el sistema de posicionamiento Echo PS™ facilita la introducción y posicionamiento de la malla durante la reparación laparoscópica de hernias abdominales. Al completar la fijación del perímetro inicial, el balón se deshincha rápidamente y se elimina por completo del cuerpo.


- Descripción general
- Instrucciones de uso electrónicas y otros recursos


Preparación de la malla
- Viene preacoplado con la malla Ventralight™ ST.
- Diseñada para asegurar que la barrera de protección se oriente hacia las vísceras.
- Reduce el tiempo de preparación de la malla y la frustración del usuario.1
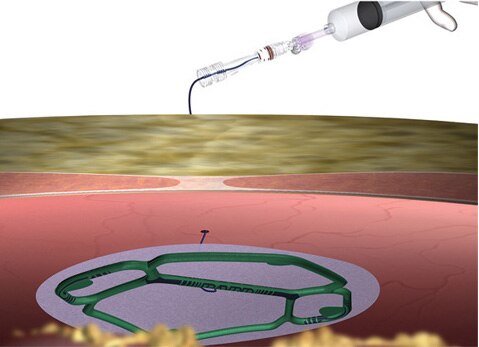
Implementación
- No requiere ningún trocar dedicado.
- Reduce potencialmente los traumatismos del paciente.
- Tras la introducción de la malla, el trocar se puede utilizar libremente para otros instrumentos laparoscópicos.
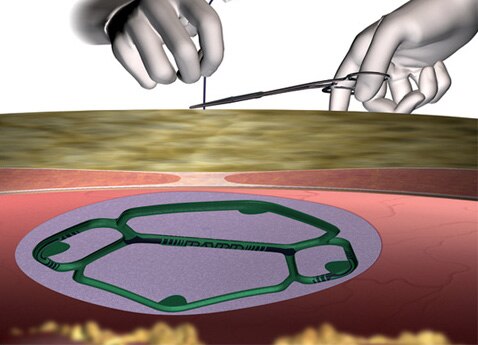
Posicionamiento
- Técnica diseñada para centrar la malla sobre la zona defectuosa.
- Mitiga las conjeturas y facilita el centrado.
En comparación con el posicionamiento con sutura transfascial, el sistema de posicionamiento Echo PS™:
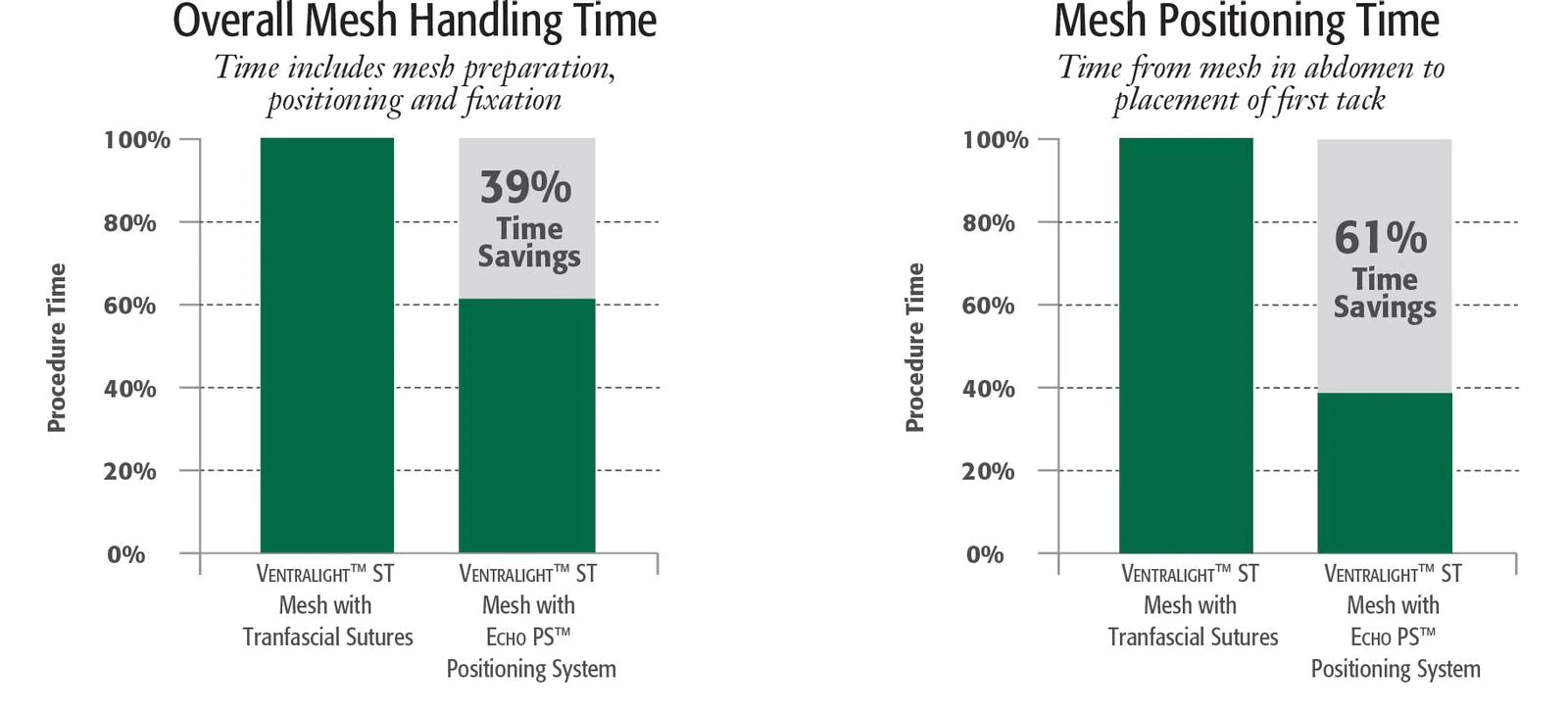
- Reduce el posicionamiento de la malla en más de un 60%1
- Reduce la variabilidad del tiempo de intervención en un 84%1
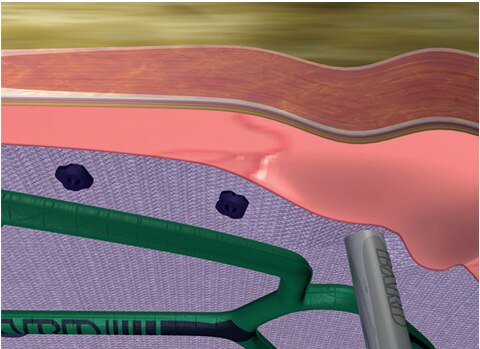
Fijación
- Únicamente hace falta la intervención de una sola persona.
- Una vez posicionada la malla con el sistema Echo PS™, la malla permanece en su lugar y permite al cirujano utilizar ambas manos para fijarla.
- No hace falta ninguna ayuda ni transferencia para sostener la malla en su lugar durante la fijación, lo que puede contribuir a aumentar la precisión.
- Diseño de balón flexible único.
- Permite que la malla se adapte a la pared abdominal.
- Ocupa menos espacio intraabdominal y se ha diseñado para no interferir en la fijación.
Resultados reproducibles
El sistema de posicionamiento Echo PS™ permite al cirujano tomar el control, lo que genera resultados reproducibles en menor tiempo.1
- El sistema de posicionamiento Echo PS™ elimina las conjeturas y facilita la precisión en el centrado y la fijación asistida de la malla sin necesidad de que intervenga más de una persona.
- Más de 3 años de experiencia clínica y un número cada vez mayor de cirujanos que adoptan esta tecnología en su práctica estándar.
- Un diseño innovador y galardonado que dinamiza las intervenciones laparoscópicas, permite ahorrar tiempo y reduce la variabilidad del tiempo de intervención en un 84%.1
En la bibliografía de BD se ofrece información que puede utilizar para continuar trabajando para alcanzar la excelencia.
En comparación con el posicionamiento con suturas transfasciales en un estudio preclínico.
Fecha archivada en C. R. Bard, Inc. Es posible que los resultados no coincidan con el desempeño en humanos.
Tenga en cuenta que es posible que no todos los productos, servicios o funciones de productos estén disponibles en su área local. Consulte con su representante local BD.
Para obtener información de seguridad más detallada y las instrucciones de uso, consulte el folleto del envase del producto.
Indicaciones
La malla Ventralight™ ST está indicada para utilizarse en la reconstrucción de deficiencias del tejido blando durante la reparación de hernias abdominales, incisionales y umbilicales. El sistema de posicionamiento Echo PS™ se ha diseñado para facilitar la introducción de la malla Ventralight™ ST durante la reparación laparoscópica de hernias.
Contraindicaciones
No utilice esta malla en bebés, niños ni mujeres embarazadas, ya que en estos casos los materiales de la malla pueden poner en peligro el crecimiento futuro.
No se ha estudiado el uso de esta malla en mujeres lactantes o embarazadas.
No utilice esta malla para la reconstrucción de defectos cardiovasculares.
La bibliografía indica que hay posibilidad de formación de adherencias cuando se coloca el polipropileno en contacto directo con el intestino o las vísceras.
Advertencias
El uso de cualquier malla permanente en una herida contaminada o infectada puede causar la formación de infecciones, fístulas o la extrusión de la malla.
Si se produce una infección, trátela de forma agresiva. Debe tenerse en cuenta la posibilidad de tener que extraer la malla. Una infección no resuelta podría conllevar la extracción de la malla.
Si una malla no utilizada ha estado en contacto con instrumentos o accesorios que se han empleado en un paciente o se contamina con líquidos corporales, deséchela con cuidado para evitar el riesgo de transmitir infecciones víricas.
Para evitar recidivas al reparar hernias, el tamaño de la malla debe ser suficiente para que se superponga adecuadamente sobre las dimensiones y la ubicación de la zona defectuosa; se debe tener en cuenta cualquier otro factor clínico aplicable al paciente. Prestar especial atención a la colocación de las fijaciones de la malla y a la separación ayudará a evitar la sobretensión o que aparezcan huecos entre la malla y el tejido fascial.
Este dispositivo se suministra estéril. Inspeccione el envase para asegurarse de que está intacto y sin daños antes de utilizarlo.
Este dispositivo está diseñado para un solo uso. La reutilización, reesterilización, reprocesamiento o reenvasado podrían afectar a la integridad estructural o a las características esenciales de los materiales y del diseño, que son fundamentales para el funcionamiento general del dispositivo, y podrían conllevar el riesgo de fallo del dispositivo, así como posibles daños al paciente. La reutilización, el reprocesamiento, la reesterilización o el reenvasado también pueden crear un riesgo de contaminación del dispositivo o causar infección o infección cruzada del paciente, incluyendo, entre otras, la transmisión de enfermedades infecciosas de un paciente a otro. La contaminación del dispositivo podría provocar lesiones, enfermedades o la muerte del paciente o el usuario final.
La malla debe utilizarse una vez abierta la bolsa de papel de aluminio exterior. No almacenar para su uso posterior. Deben desecharse las partes no utilizadas de la malla.
Asegúrese de orientar bien la malla; la parte recubierta de la malla debe orientarse hacia los intestinos o los órganos sensibles. No coloque la parte de polipropileno hacia los intestinos. Puede haber posibilidad de formación de adherencias cuando se coloca el lado de polipropileno en contacto directo con el intestino o las vísceras (consulte la sección Orientación de la superficie).
No aplique dispositivos afilados, que emitan calor o ultrasónicos (como tijeras, agujas, grapadoras, herramientas diatérmicas, etc.) al sistema de posicionamiento Echo PS™.
El sistema de posicionamiento Echo PS™ no debe utilizarse con ninguna otra malla para hernia aparte de aquellas con las que venga preaplicado o envasado.
La malla Ventralight™ ST es el único componente de implante permanente del dispositivo. El adaptador y la jeringa de inflación deben mantenerse fuera del cuerpo del paciente y desecharse después de utilizarse. El sistema de posicionamiento Echo PS™ (incluido el balón, todos los conectores y el tubo de hinchado) debe extraerse del paciente y desecharse adecuadamente. No forma parte del implante permanente.
Después de utilizarlos, deseche el introductor y todos los componentes del sistema de posicionamiento Echo PS™ (incluidos el adaptador de hinchado y la jeringa). Este producto puede constituir un riesgo biológico potencial. Manipúlelo y deséchelo conforme a la práctica médica aceptada y a las leyes y normativas locales, estatales y federales correspondientes.
Esta malla no debe utilizarse para reparar prolapsos de órganos pélvicos a través de un abordaje transvaginal.
Esta malla no debe utilizarse para tratar la incontinencia urinaria causada por estrés.
Precauciones
Lea todas las instrucciones antes de utilizar el producto.
Solo los médicos cualificados en las técnicas quirúrgicas apropiadas deben utilizar este dispositivo.
No se ha evaluado la seguridad ni la eficacia de la malla Ventralight™ ST con el sistema de posicionamiento Echo PS™ en estudios clínicos en presencia de tumores en la cavidad abdominopélvica.
Debe mantener la visualización durante toda la intervención. Además, debe realizar la retirada laparoscópica del sistema de posicionamiento Echo PS™ con suficiente visualización de todo el dispositivo y de la anatomía circundante, para retirarlo correctamente.
No corte la malla. Esto afectará a la interfaz entre la malla y el sistema de posicionamiento.
Reacciones adversas
Entre las posibles complicaciones se incluyen, entre otras, seroma, adhesión, hematoma, dolor, infección, inflamación, extrusión, erosión, migración, formación de fístulas, reacción alérgica y recidiva de la hernia o del tejido blando defectuoso.
BD-114960

