Referencias
- LeBlanc K. “Proper mesh overlap is a key determinant in hernia recurrence following laparoscopic ventral and incisional hernia repair“ Hernia, febrero de 2016;20(1):85-99.
- Liang, M. K., Clapp, M. L., Garcia, A., Subramanian, A., Awad, S. S. “Mesh shift following laparoscopic ventral hernia repair.” J Surg Res. Septiembre de 2012;177(1):e7-13.
- Tollens, T., Topal, H., Ovaere, S., Beunis, A., Vermeiren, K., Aelvoet, C. “Prospective analysis of ventral hernia repair using the Ventralight™ ST hernia patch.” Surg Technol Int. Septiembre de 2013;23:113-6.
- Las referencias están disponibles previa solicitud.
Tenga en cuenta que es posible que no todos los productos, servicios o funciones de productos estén disponibles en su área local. Consulte con su representante local BD.
Indicaciones
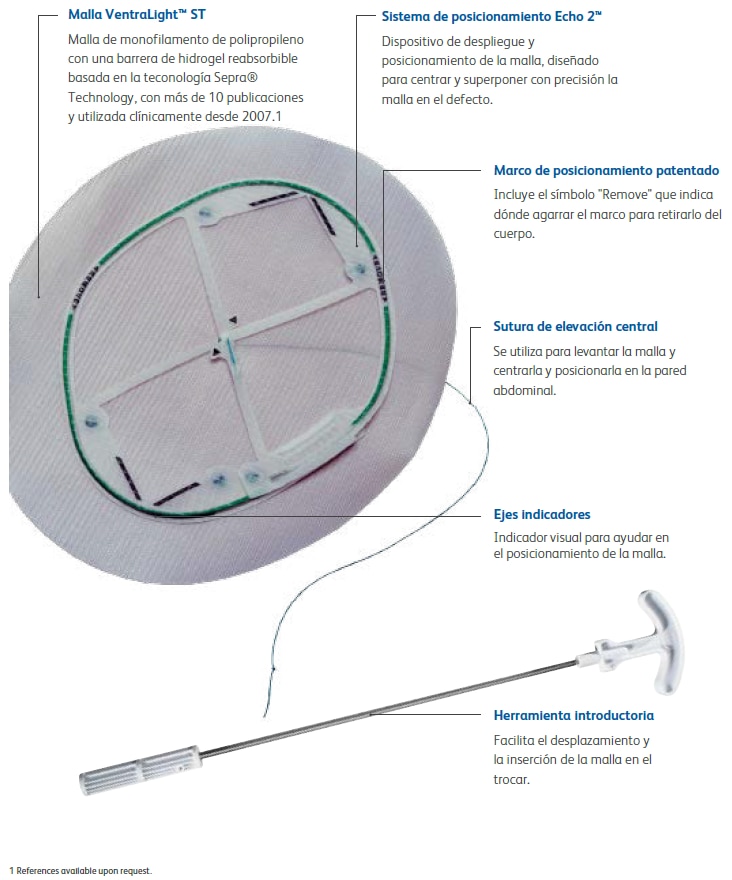
La malla Ventralight™ ST está indicada para utilizarse en la reconstrucción de deficiencias de tejido blando durante la reparación de hernias abdominales, incisionales y umbilicales. El sistema de posicionamiento Echo 2™ se ha diseñado para facilitar la introducción y el posicionamiento de la malla Ventralight™ ST durante la reparación laparoscópica de hernias.
Contraindicaciones
1. No utilice esta malla en bebés, niños ni mujeres embarazadas, ya que en estos casos los materiales de la malla pueden poner en peligro el crecimiento futuro.
2. No se ha estudiado el uso de esta malla en mujeres lactantes o embarazadas.
3. No utilice esta malla para la reconstrucción de defectos cardiovasculares.
4. La bibliografía indica que puede haber posibilidad de formación de adherencias cuando se coloca el polipropileno en contacto con el intestino o las vísceras.
Advertencias
1. El uso de cualquier malla permanente en una herida contaminada o infectada puede causar la formación de fístulas o la extrusión de la malla.
2. Si se produce una infección, trátela de forma agresiva. Debe tenerse en cuenta la posibilidad de tener que extraer la malla. Una infección no resuelta podría conllevar la extracción de la malla.
3. Si una malla no utilizada ha estado en contacto con instrumental o accesorios que se han usado en un paciente o se contamina con fluidos corporales, deséchela con cuidado para evitar el riesgo de transmitir infecciones víricas.
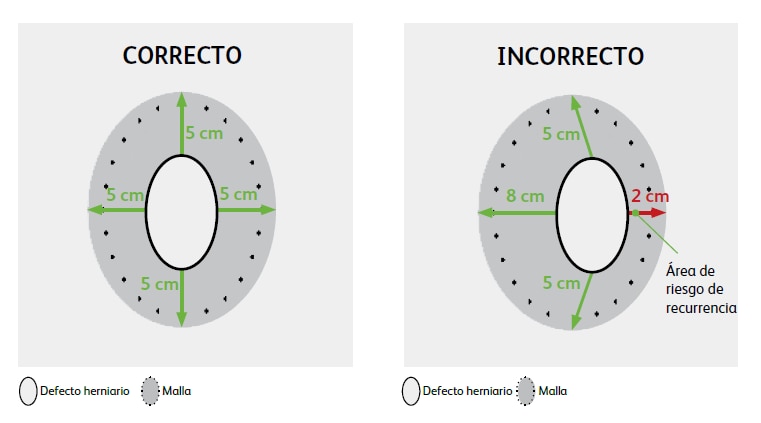
4. Para evitar recidivas al reparar hernias, el tamaño de la malla debe ser suficiente para que se superponga adecuadamente sobre las dimensiones y la ubicación de la zona defectuosa; se debe tener en cuenta cualquier otro factor clínico aplicable al paciente. Debe prestarse atención a la colocación de las fijaciones de la malla y a los espacios, ya que se ayudará a evitar la sobretensión o la aparición de huecos entre la malla y el tejido fascial.
5. Este dispositivo se suministra estéril. Inspeccione el envase para asegurarse de que está intacto y sin daños antes de utilizarlo.
6. Este dispositivo se ha diseñado para un solo uso. La reutilización, reesterilización, reprocesamiento o reenvasado podrían afectar a la integridad estructural o a las características esenciales de los materiales y del diseño, que son fundamentales para el funcionamiento general del dispositivo, y podrían conllevar el riesgo de fallo del dispositivo, así como posibles daños al paciente. La reutilización, el reprocesamiento, la reesterilización o el reenvasado también pueden crear un riesgo de contaminación del dispositivo o causar infección o infección cruzada del paciente, incluyendo, entre otras, la transmisión de enfermedades infecciosas de un paciente a otro. La contaminación del dispositivo podría provocar lesiones, enfermedades o la muerte del paciente o el usuario final.
7. Esta malla debe utilizarse una vez abierta la bolsa de papel de aluminio exterior. No almacenar para su uso posterior. Deben desecharse las partes no utilizadas de la malla.
8. Asegúrese de orientar bien la malla; la parte recubierta de la malla debe orientarse hacia los intestinos o los órganos sensibles. No coloque la parte de polipropileno hacia los intestinos. Puede haber posibilidad de formación de adherencias cuando se coloca el lado de polipropileno en contacto directo con el intestino o las vísceras (consulte la sección "Orientación de la superficie").
9. No aplique dispositivos afilados o con punta ni herramientas ultrasónicas (como tijeras, agujas, grapadoras, herramientas diatérmicas, etc.) al marco del sistema de posicionamiento Echo 2™.
10. Este dispositivo contiene alambre de nitinol superelástico; no lo corte y evite el acoplamiento o el contacto directo con electrodos quirúrgicos activos.
11. La malla Ventralight™ ST es el único implante permanente del dispositivo. El sistema de posicionamiento Echo 2™ (que incluye el marco de despliegue, la sutura de elevación central y todos los conectores) debe extraerse del paciente y eliminarse de forma apropiada. No forma parte del implante permanente.
12. El sistema de posicionamiento Echo 2™ no debe utilizarse con ninguna otra malla para hernia aparte de aquellas con las que venga preacoplado o envasado.
13. Deseche el sistema de posicionamiento Echo 2™ (incluido el marco, la sutura de elevación central, todos los conectores y el introductor de malla) después de utilizarlo. Pueden suponer un peligro biológico. Manipúlelo y elimínelo conforme a la práctica médica aceptada, y a las normativas y leyes federales, estatales y locales aplicables.
14. Esta malla no debe utilizarse para reparar prolapsos de órganos pélvicos a través de un abordaje transvaginal.
15. Esta malla no debe utilizarse para tratar la incontinencia urinaria causada por estrés.
Precauciones
1. Lea todas las instrucciones antes de utilizar el producto.
2. Este producto solo deben utilizarlo médicos debidamente cualificados y formados en las técnicas quirúrgicas pertinentes.
3. No se ha evaluado la seguridad ni la eficacia del dispositivo en estudios clínicos en presencia de tumores en la cavidad abdominopélvica.
4. Debe mantener la visualización durante toda la intervención. Además, para realizar correctamente la retirada laparoscópica del sistema de posicionamiento Echo 2™, debe tener suficiente visualización de todo el dispositivo y de la anatomía circundante.
5. No recorte la malla. Esto afectará a la interfaz entre la malla y el sistema de posicionamiento.
Reacciones adversas
Entre las posibles complicaciones se incluyen, entre otras, seroma, adhesión, hematoma, dolor, infección, inflamación, extrusión, erosión, migración, formación de fístulas, reacción alérgica y recidiva de la hernia o del tejido blando defectuoso.
Consulte el prospecto del paquete para obtener información de seguridad e instrucciones de uso más detalladas.