Les données obtenues dans le cadre des recherches sur des animaux pourraient ne pas correspondre aux résultats obtenus chez les humains. Données archivées.
Indications
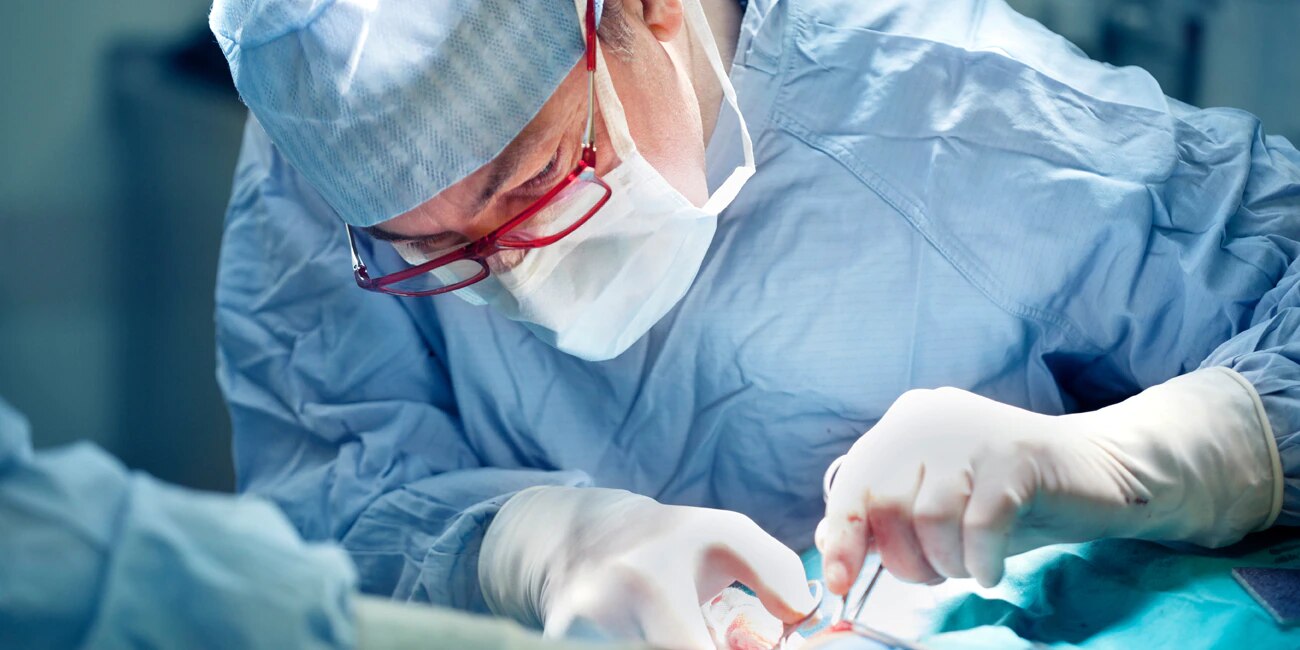
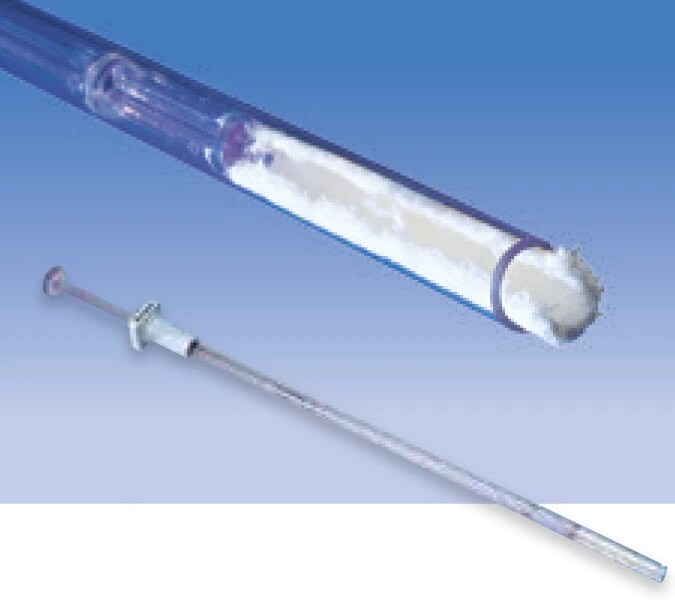
L’agent hémostatique au collagène microfibrillaire (MCH) Avitene™ et la compresse Avitene™ UltraFoam™ sont utilisés au cours d’interventions chirurgicales en tant que méthode d’hémostase d’appoint lorsque les procédures de ligature ou conventionnelles pour contrôler les saignements sont inefficaces ou non praticables.
Contre-indications
- L’agent hémostatique au collagène microfibrillaire (MCH) Avitene™ et les compresses Avitene™ UltraFoam™ ne doivent pas servir à la fermeture d’incisions cutanées, car ils pourraient compromettre la cicatrisation des rebords de la plaie. Cela est causé par une simple interposition mécanique du collagène séché et non pas par une interférence intrinsèque avec la cicatrisation de la plaie.
- Il a été rapporté qu’avec d’autres agents hémostatiques au collagène, le remplissage des porosités de l’os spongieux pourrait réduire significativement la force d’adhérence des adhésifs au méthyl méthacrylate. L’agent hémostatique au collagène microfibrillaire (MCH) Avitene™ et la compresse Avitene™ UltraFoam™ ne devraient pas être utilisés sur les surfaces osseuses sur lesquelles du matériel prosthétique doit être fixé avec des adhésifs au méthacrylate de méthyle.
Avertissements
- L’agent hémostatique au collagène microfibrillaire (MCH) Avitene™ et Avitene™ UltraFoam™ sont inactivés par autoclavage.
- L’oxyde d’éthylène réagit avec l’acide chlorhydrique lié afin de former du chlorhydrate d’éthylène.
- Ces dispositifs ont été conçus pour un usage unique. Leur réutilisation, retraitement, restérilisation ou reconditionnement peuvent compromettre l’intégrité structurelle ou les principales caractéristiques de la conception ou du matériau, essentielles aux performances générales du dispositif, et conduire à un dysfonctionnement de ce dernier, pouvant ainsi causer des blessures au patient. La réutilisation, le retraitement, la restérilisation ou le reconditionnement du dispositif peuvent également générer un risque de contamination de ce dernier ou entraîner une infection ou une infection croisée chez le patient, notamment la transmission de maladies infectieuses d’un patient à un autre. La contamination des dispositifs peut entraîner des blessures, une maladie, voire le décès du patient ou de l’utilisateur final. Tout produit ouvert et non utilisé doit être éliminé.
- L’humidification de l’agent hémostatique au collagène microfibrillaire Avitene avec de l’eau ou avec du sérum physiologique ou de la thrombine altère son efficacité hémostatique. Le produit devrait être utilisé sec.
- Comme c’est le cas pour tout corps étranger, l’usage de l’agent hémostatique au collagène microfibrillaire Avitene™ et des compresses Avitene™ UltraFoam™ dans une plaie contaminée peut aggraver l’infection.
- La compresse Avitene™ UltraFoam™ ne doit pas être utilisée dans les cas d’hémorragie artérielle transfusée.
- L’Avitene™ Ultrafoam™ ne doit pas non plus servir dans les cas où le sang ou d’autres liquides se sont accumulés ou dans les cas où le point d’hémorragie est submergé; la compresse pourrait masquer une source de saignement sous-jacente et entraîner la formation d’un hématome.
- La compresse Avitene™ UltraFoam™ ne servira pas de tampon ou de bouchon dans un site d’où le sang s’écoule; elle ne permettra pas de fermer une zone d’accumulation de sang derrière un tampon.
- La compresse Avitene™ UltraFoam™ n’a pas été conçue pour traiter les troubles de coagulation systémiques.
- L’agent hémostatique au collagène microfibrillaire (MCH) Avitene™ et la compresse Avitene™ UltraFoam™ ne sont pas destinés aux injections ou à des utilisations intra-oculaires ou intra-vasculaires.
Réactions indésirables
- Les réactions indésirables les plus graves ayant été signalées comme susceptibles d’être liées à l’usage de l’agent hémostatique au collagène microfibrillaire (MCH) Avitene™ ou d’autres produits au collagène sont la potentialisation d’infections, notamment la formation d’abcès et d’hématomes, la déhiscence des plaies et les médiastinites.
- Les autres réactions indésirables signalées qui pourraient y être associées sont la formation d’adhérences, des réactions allergiques, des réactions à la présence d’un corps étranger et un sérome sous-galéal (un seul cas signalé), ainsi qu’une fréquence accrue des ostéites alvéolaires lorsque ces produits sont utilisés pour combler une cavité d’extraction dentaire.
- Des laryngospasmes transitoires causés par l’aspiration de matériel sec ont été signalés suite à l’utilisation d’agent hémostatique au collagène microfibrillaire (MCH) Avitene™ dans des amygdalectomies.
Veuillez consulter la notice de l’emballage pour en savoir plus sur la sécurité et le mode d’emploi.