Lutonix™ DCB-ballonkatheters met geneesmiddelcoating
Angioplastiek-ballonnen met paclitaxelcoating

- Overzicht
- Kenmerken
- Klinische gegevens
- EIFU en bronnen
De Lutonix™ DCB-ballonkatheter met paclitaxelcoating wordt geleverd in voerdraadconfiguraties van 0,018" en 0,035" voor de behandeling van perifere arteriële aandoeningen in de a. femoralis superficialis en a. poplitea.
De Lutonix™ DCB (drug coated balloon, ballon met paclitaxelcoating) geeft een dosis af van 2 μg/mm2 paclitaxel en is bedoeld om de veelzijdigheid te bieden die nodig is voor het behandelen van laesies van verschillende grootte en lengten. Hij is ontwikkeld om femoropopliteale procedures te verbeteren middels:
- Een robuuste matrix van groottes
- Uitgebreide indicaties
- Bewezen resultaten in een niveau 1 klinische trial1

- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
Lage geneesmiddeldosis:
optimale geneesmiddeldosis van 2 μg/mm2 paclitaxel
Taps toelopende tip:
bedoeld om het opvoeren van de katheter naar en door het stenotische gebied van het vat te vergemakkelijken.
Laag sheath profiel:
5F of minder
Duurzame coating:
bedoeld om geneesmiddelverspreiding tijdens bereiding en hantering te beperken
Ballonlengtes tot 300 mm bij geselecteerde 0,018-groottes
In de VS uitsluitend DCB van 300 mm beschikbaar.2
Katheterlengte 100 cm en 130 cm:
om tegemoet te komen aan de toegangslocatie van uw voorkeur
Compatibele 0,018- en 0,035-voerdraden:
ter ondersteuning van uw behandelingsalgoritmen
Het GeoAlign™-markeringssysteem is een gestandaardiseerde niet-radiopake liniaal op de katheterschacht, bedoeld om:
- herhaalde katheterplaatsing te vergemakkelijken
- de efficiëntie van de procedure te verhogen
1 Gegevens van klinische trial LEVANT 2 beschikbaar. N=476. Na 12 maanden resulteerde de behandeling met Lutonix™ 035 in een percentage primaire doorgankelijkheid van 73,5% versus 56,8% met alleen PTA (p=0,001). Primaire doorgankelijkheid gedefinieerd als vrijheid van binaire restenose gedefinieerd door DUS PSVR ≥ 2,5 en vrijheid van doellaesie-revascularisatie (TLR). Na 12 maanden resulteerde de behandeling met Lutonix™ 035 DCB in een percentage vrijheid van primaire veiligheidsvoorvallen van 86,8% versus 81,9% met alleen PTA (p=0,185). Primaire veiligheid gedefinieerd als het samenvoegen van de vrijheid van perioperatief overlijden ongeacht de oorzaak en de vrijheid in het indexledemaat van amputatie (boven of onder de knie), herinterventie en overlijden gerelateerd aan het ledemaat na 1 jaar. De gerapporteerde aantallen zijn Kaplan-Meier-analyses, niet vooraf gespecificeerd.
3 GeoAlign™-markeringen zijn geen vervanging voor fluoroscopie. Wanneer de katheter in het vaatstelsel is ingebracht, moet de locatie van de ballon onder hoogwaardige fluoroscopie worden bevestigd. Dieronderzoek (herhaalde PTA in varkensarterie) werd uitgevoerd door 3 artsen die de Lutonix™ 035 DCB (zonder geneesmiddel) en de Ultraverse™ 035 PTA-katheter, beide met GeoAlign™-markeringen, testten op POBA zonder GeoAlign™-markeringen (n= 112, test n = 96, controle n = 16). Dierproefgegevens beschikbaar. De BD-dierproefresultaten kunnen afwijken van de klinische prestatie. Verschillende testmethoden kunnen verschillende resultaten opleveren.
Raadpleeg de IFU voor gebruiksaanwijzing, contra-indicaties, waarschuwingen, voorzorgsmaatregelen, complicaties, bijwerkingen en gedetailleerde veiligheidsinformatie voor het product. ℞ only
BD-38946
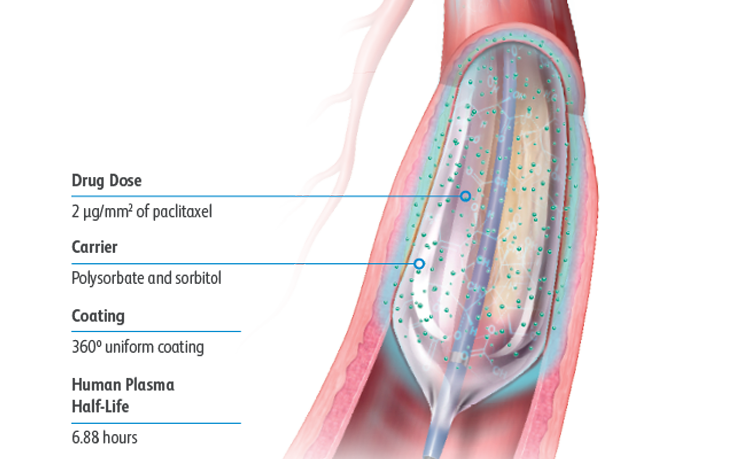
De Lutonix™ DCB-formulering werd ontworpen voor een optimale balans tussen veiligheid en werkzaamheid met een dosis van 2 μg/mm2 en polysorbaat en sorbitol als hulpstoffen, die samen een effectieve overdracht van het geneesmiddel naar de vaatwand mogelijk maken.
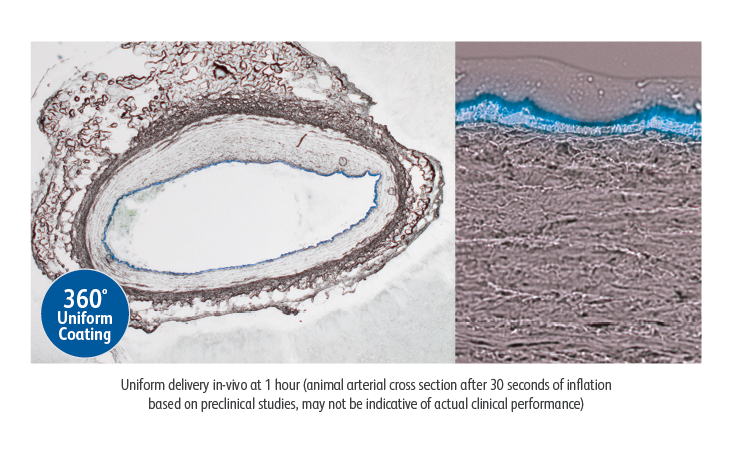
De Lutonix™ 035 DCB vertoonde een consistente coating, wat heeft geleid tot:
- 360° paclitaxelcoating van de arterie1
- Coatingdikte ~6,46 μm1

De Lutonix™ DCB-coating is bedoeld om:
- te zorgen voor een snelle opname van het geneesmiddel in de vaatwand tijdens het vullen;
- te zorgen voor een uniforme toediening van het geneesmiddel aan de vaatwand;
- te helpen de onnodige blootstelling van het personeel en de patiënt aan het geneesmiddel tot een minimum te beperken.
In een schudtest met droge vulling vertoonde de Lutonix™ 035 DCB < 0,1% verlies van geneesmiddel2
Uit gegevens van een preklinisch dieronderzoek bleek dat Lutonix™ DCB de gewenste farmacologische niveaus met biologische effecten had zonder bewijs van significante embolie stroomafwaarts of systemische toxiciteit.3
1 Gegevens van een simulatietest en preklinisch dieronderzoek zijn beschikbaar. De simulatietestresultaten en preklinische gegevens kunnen afwijken van de klinische prestatie. Verschillende testmethoden kunnen verschillende resultaten opleveren.
2 Gegevens schudsimulatietest met droog vulmiddel zijn beschikbaar bij BD, Tempe AZ. Bij de schudtest werd de gemiddelde hoeveelheid geneesmiddelverlies gemeten nadat de ballon was gevuld en er met het hulpmiddel vijf keer licht tegen de zijkant van een centrifugebuis werd getikt, zowel links als rechts. n=5. De simulatietestresultaten kunnen afwijken van de klinische prestatie. Verschillende testmethoden kunnen verschillende resultaten opleveren.
3 Gegevens Virmani preklinisch dieronderzoek GLP. Preklinische gegevens beschikbaar. De preklinische resultaten kunnen afwijken van de klinische prestatie. Verschillende testmethoden kunnen verschillende resultaten opleveren.
Raadpleeg de IFU voor gebruiksaanwijzing, contra-indicaties, waarschuwingen, voorzorgsmaatregelen, complicaties, bijwerkingen en gedetailleerde veiligheidsinformatie voor het product. ℞ only
BD-38946
Het Lutonix Global SFA Real-World Registry toonde een aanhoudende werkzaamheid van Lutonix™ 035 DCB aan bij heterogene patiëntenpopulatie in de real-world klinische praktijk.1
Het primaire werkzaamheidseindpunt werd gemeten als Kaplan-Meier (KM) vrijheid van volledige doellaesie-revascularisatie en bleek 94,1% te zijn na 12 maanden en 90,3% na 24 maanden.1
De werkzaamheid van de Lutonix™ 035 DCB bleef ook behouden in subgroepen van lange laesies en in-stent restenose, met respectievelijk 88,2% en 84,6% vrijheid van TLR na 24 maanden.1
Het pivotale LEVANT 2-onderzoek is een wereldwijd, prospectief, enkelblind, gerandomiseerd onderzoek in 54 centra (42 centra in de Verenigde Staten en 12 in Europa) waarin alle patiënten onder één protocol zijn opgenomen, waarbij de Lutonix™ 035 DCB wordt vergeleken met standaard PTA.2
Het onderzoek voldoet aan de primaire eindpunten voor veiligheid en werkzaamheid.
- Veiligheid: Lutonix™ 035 vertoonde een veiligheidsprofiel dat consistent is met PTA
- Werkzaamheid: Lutonix™ 035 vertoonde een 29,4% beter primaire-doorgankelijkheidspercentage na 12 maanden dan PTA
1 Lutonix Global SFA Real-World Registry, n=691. Het primaire veiligheidseindpunt was vrijheid van herinterventie van de arterie, amputatie van belangrijk indexledemaat en hulpmiddel- of proceduregerelateerd overlijden na 30 dagen. Vrijheid van primaire veiligheidsvoorvallen na 30 dagen bedroeg 99,4% (681/681). Het primaire effectiviteitseindpunt wordt gedefinieerd als vrijheid van TLR na 12 maanden. Het TLR-vrije percentage per proefpersoon na 12 maanden was 93,4% (605/648). De Kaplan-Meier-schatting van TLR-vrije overleving was 94,1%. Lange laesies werden gedefinieerd als elke laesie >= 140 mm. Alle proefpersonen die met de Lutonix™ 035 DCB zijn behandeld. In het LEVANT 2 IDE klinische trial resulteerde behandeling met Lutonix™ 035 DCB in een percentage vrijheid van TLR van 87,7% na 12 maanden (250/285) en in een percentage vrijheid van TLR van 82,0% na 24 maanden. Gegevens beschikbaar bij Becton, Dickinson & Company.
1 Gegevens van klinisch trial LEVANT 2 beschikbaar. N=476. Na 12 maanden resulteerde de behandeling met Lutonix™ 035 in een percentage primaire doorgankelijkheid van 73,5% versus 56,8% met alleen PTA (p=0,001). Primaire doorgankelijkheid gedefinieerd als vrijheid van binaire restenose gedefinieerd door DUS PSVR ≥ 2,5 en vrijheid van doellaesie-revascularisatie (TLR). Na 12 maanden resulteerde de behandeling met Lutonix™ 035 DCB in een percentage vrijheid van primaire veiligheidsvoorvallen van 86,8% versus 81,9% met alleen PTA (p=0,185). Primaire veiligheid gedefinieerd als het samenvoegen van de vrijheid van perioperatief overlijden ongeacht de oorzaak (<= 30 dagen) en de vrijheid in het indexledemaat van amputatie (boven of onder de knie), herinterventie en overlijden gerelateerd aan het ledemaat na 1 jaar. De gerapporteerde aantallen zijn Kaplan-Meier-analyses, niet vooraf gespecificeerd.
Raadpleeg de IFU voor gebruiksaanwijzing, contra-indicaties, waarschuwingen, voorzorgsmaatregelen, complicaties, bijwerkingen en gedetailleerde veiligheidsinformatie voor het product. ℞ only
BD-38946
De literatuurcollectie van BD over de industrie en over ons aanbod geeft u informatie die u kunt gebruiken om te blijven streven naar uitmuntendheid
Raadpleeg de IFU voor gebruiksaanwijzing, contra-indicaties, waarschuwingen, voorzorgsmaatregelen, complicaties, bijwerkingen en gedetailleerde veiligheidsinformatie voor het product. ℞ only
BD-38946