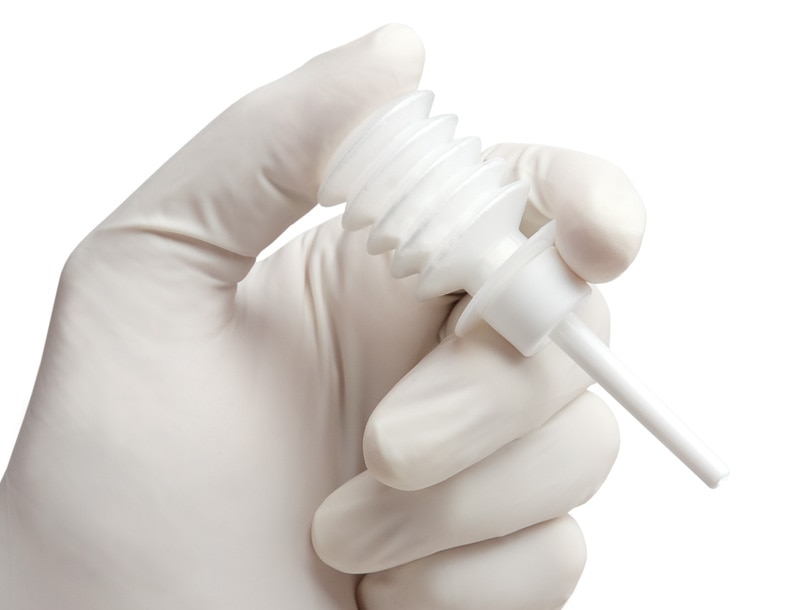
-
Applicateur Arista™ AH FlexiTip™ XL, 38 cm, 5 par caisse
SKU/REF am0005
-
Applicateur Arista™ AH FlexiTip™, 14 cm (comprend deux applicateurs), 5 par caisse
Comprend deux applicateurs
SKU/REF am0004
true
Soutien
Service à la clientèle et commande
866 979 9408, (905 288 6000 non toll free)
Nous contacter
Merci d'avoir contacté notre équipe commerciale!
Un représentant commercial vous contactera sous peu
- Présentation
- Principales caractéristiques
- Produits et accessoires
- Mode d’emploi en version électronique et ressources
- FAQ
Simple. Sûr. Efficace.
Arista™ AH est une poudre hémostatique chirurgicale absorbable d’origine végétale à 100 % dérivée d’amidon végétal purifié. La puissance d’Arista™ AH repose sur ses hémosphères polysaccharidiques microporeuses, une technologie brevetée de coagulation sanguine.
L’utilisation d’Arista™ AH est indiquée au cours d’interventions chirurgicales (sauf les interventions neurologiques et ophtalmiques) en tant que dispositif hémostatique d’appoint pour aider au contrôle des saignements capillaires, veineux et artériolaires en supplément de la pression, de la ligature et de tout autre moyen conventionnel si ceux-ci s’avèrent inefficaces ou non praticables.
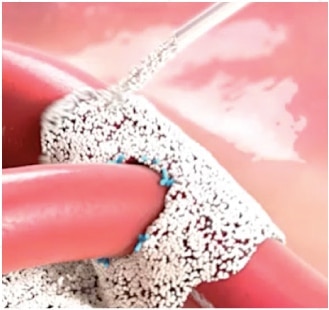
SIMPLE
- Aucun mélange ni aucune réfrigération nécessaires
- Prêt sur demande, avec une durée de conservation de cinq ans
- Retirez le bouchon et appliquez la poudre directement sur le point de saignement2
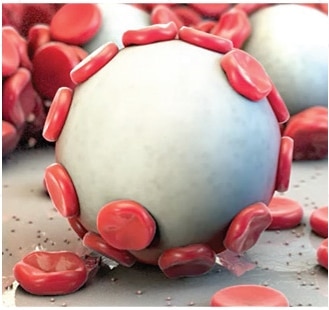
SÛR
- Sans thrombine, biocompatible et apyrogène
- Normalement absorbé et éliminé sous 24 à 48 heures* par les amylases
* Les données montrent que les nouveau-nés jusqu’aux bébés âgés de moins de 10 mois peuvent présenter une réduction de l’activité des amylases; les taux de résorption d’Arista™ AH au sein de cette population pourraient donc excéder 48 heures.
Technologie exclusive MPH™ : une approche unique d’atteinte de l’hémostase
La puissance d’Arista™ AH repose sur sa technologie MPH™ (hémosphères polysaccharidiques microporeuses) exclusive. Les sphères, composées de particules microporeuses dont la taille des pores est contrôlée, sont conçues pour faire effet de tamis moléculaire. L’action osmotique puissante déshydrate et gélifie le sang au contact afin d’accélérer le processus de coagulation naturel.

EFFICACE
- Le processus de coagulation débute au contact, quel que soit le statut de coagulation du patient3
- Atteinte de l’hémostase complète en quelques minutes seulement1
- Assure une grande couverture sur les surfaces inégales et les zones difficiles à atteindre
1 Étude clinique Arista™ AH PMA P050038.
2 Consultez le mode d’emploi intégral pour obtenir les directives d’application détaillées.
3 Mode d’emploi d’Arista™ AH.
INDICATIONS
L’utilisation d’Arista™ AH est indiquée au cours d’interventions chirurgicales (sauf les interventions neurologiques et ophtalmiques) en tant que dispositif hémostatique d’appoint pour assister au contrôle des saignements capillaires, veineux et artériolaires en supplément de la pression, de la ligature et de tout autre moyen conventionnel si ceux-ci s’avèrent inefficaces ou non praticables.
CONTRE-INDICATIONS
N’injectez ou n’appliquez pas d’Arista™ AH dans les vaisseaux sanguins; sa présence représente un risque d’embolie pouvant causer la mort.
AVERTISSEMENTS
L’Arista™ AH n’a pas été conçu pour se substituer à une technique chirurgicale méticuleuse ni à l’application adéquate de ligatures ou d’autres méthodes conventionnelles d’hémostase.
Une fois l’hémostase atteinte, l’excès d’Arista™ AH doit être éliminé du site d’application par irrigation et aspiration, surtout si le produit est utilisé près des foramens osseux et des zones à proximité des os, de la moelle épinière ou du nerf optique et du chiasma optique.L’Arista™ AH gonfle pour atteindre son volume maximal dès son contact avec le sang ou tout autre liquide. Tout Arista™ AH sec et blanc doit être éliminé. La possibilité d’interférence du produit avec une fonction normale ou d’apparition d’une nécrose de compression des tissus environnants due au gonflement est réduite par l’élimination de l’excès de matières sèches.
L’innocuité et l’efficacité cliniques de l’Arista™ AH n’ont pas été testées chez les enfants et les femmes enceintes. Les données montrent que les nouveau-nés jusqu’aux bébés âgés de moins de 10 mois peuvent présenter une réduction de l’activité des amylases; les taux de résorption d’Arista™ AH au sein de cette population pourraient donc excéder 48 heures.
L’utilisation d’Arista™ AH en présence d’une infection ou sur une zone corporelle contaminée doit se faire avec précaution. Une nouvelle chirurgie pourrait être nécessaire en présence de signes d’infection ou de développement d’un abcès au site d’application d’Arista™ AH afin de permettre le drainage.
L’innocuité et l’efficacité du produit dans le cadre d’interventions neurochirurgicales et ophtalmiques n’ont pas été déterminées.
L’Arista™ AH ne doit pas servir au contrôle des saignements après un accouchement ou des ménorragies.
PRÉCAUTIONS
Lorsque l’Arista™ AH est utilisé conjointement avec des circuits de récupération de sang autologue, suivez attentivement les directives données dans la section Administration du mode d’emploi concernant l’exécution d’une filtration appropriée et d’un lavage cellulaire.
L’Arista™ AH a été conçu pour être utilisé à l’état sec. Un contact préalable à l’application et à l’atteinte de l’hémostase avec une solution saline ou antibiotique entraînera une perte de potentiel hémostatique.
L’utilisation d’Arista™ AH n’est pas recommandée pour le traitement primaire des troubles de la coagulation.
Aucun essai n’a été réalisé pour vérifier l’utilisation d’Arista™ AH sur les surfaces osseuses sur lesquelles des matières prothétiques doivent être fixées avec un adhésif; une telle utilisation n’est donc pas recommandée.
L’Arista™ AH est livré stérile et ne peut pas être stérilisé à nouveau. Tout contenant d’Arista™ AH ouvert et inutilisé doit être éliminé.
N’appliquez pas d’Arista™ AH en quantités excédant 50 g chez un patient diabétique; il a été calculé qu’une quantité excédant 50 g pourrait avoir un impact sur la charge glycémique.
L’Arista™ AH ne doit pas être laissé dans le bassin rénal ni dans les uretères lors des interventions urologiques visant l’élimination des foyers potentiels de formation de calculs.
RÉACTIONS INDÉSIRABLES
Aucun des événements indésirables survenus au cours d’un essai clinique prospectif randomisé à contrôle concurrent n’a été jugé comme étant lié à l’usage de l’Arista™ AH par le comité de surveillance de la sécurité des données. Les événements indésirables les plus fréquents se sont avérés être des douleurs liées à la chirurgie, une anémie, des nausées, des valeurs d’analyses de laboratoire hors des plages normales, de l’arythmie, de la constipation, de la défaillance respiratoire et de l’hypotension. Tous ces événements ont été signalés dans une proportion supérieure à 10 % chez les patients traités avec l’Arista™ AH. Les détails des événements indésirables survenus au cours de cet essai clinique peuvent être consultés dans le mode d’emploi accompagnant le produit; ils sont également disponibles sur le site www.bd.com.
Mise en garde : La loi fédérale (des États-Unis) restreint la vente de ce dispositif par ou sur ordonnance d’un médecin agréé ou d’un praticien dûment agréé.
BD-14602
Que sont les agents hémostatiques absorbables et comment fonctionnent-ils?
Qu’est-ce qu’un agent hémostatique absorbable?
Les agents hémostatiques absorbables sont utiles en tant que traitement d’appoint pendant les interventions chirurgicales lorsque les méthodes classiques ne contrôlent pas le saignement chirurgical. 1

Les agents hémostatiques et leur utilisation
Les agents hémostatiques sont des substances contribuant à prévenir/arrêter les saignements du site hémorragique et impliquent les réactions dépendantes des protéines plasmatiques, des ions de calcium et des plaquettes sanguines, ce qui ramollit le bouchon plaquettaire de la conversion de fibrinogène en fibrine.
1 Étude clinique Arista™ AH PMA P050038.
2 Consultez le mode d’emploi intégral pour obtenir les directives d’application détaillées.
3 Mode d’emploi d’Arista™ AH.
INDICATIONS
L’utilisation d’Arista™ AH est indiquée au cours d’interventions chirurgicales (sauf les interventions neurologiques et ophtalmiques) en tant que dispositif hémostatique d’appoint pour assister au contrôle des saignements capillaires, veineux et artériolaires en supplément de la pression, de la ligature et de tout autre moyen conventionnel si ceux-ci s’avèrent inefficaces ou non praticables.
CONTRE-INDICATIONS
N’injectez ou n’appliquez pas d’Arista™ AH dans les vaisseaux sanguins; sa présence représente un risque d’embolie pouvant causer la mort.
AVERTISSEMENTS
L’Arista™ AH n’a pas été conçu pour se substituer à une technique chirurgicale méticuleuse ni à l’application adéquate de ligatures ou d’autres méthodes conventionnelles d’hémostase.
Une fois l’hémostase atteinte, l’excès d’Arista™ AH doit être éliminé du site d’application par irrigation et aspiration, surtout si le produit est utilisé près des foramens osseux et des zones à proximité des os, de la moelle épinière ou du nerf optique et du chiasma optique.L’Arista™ AH gonfle pour atteindre son volume maximal dès son contact avec le sang ou tout autre liquide. Tout Arista™ AH sec et blanc doit être éliminé. La possibilité d’interférence du produit avec une fonction normale ou d’apparition d’une nécrose de compression des tissus environnants due au gonflement est réduite par l’élimination de l’excès de matières sèches.
L’innocuité et l’efficacité cliniques de l’Arista™ AH n’ont pas été testées chez les enfants et les femmes enceintes. Les données montrent que les nouveau-nés jusqu’aux bébés âgés de moins de 10 mois peuvent présenter une réduction de l’activité des amylases; les taux de résorption d’Arista™ AH au sein de cette population pourraient donc excéder 48 heures.
L’utilisation d’Arista™ AH en présence d’une infection ou sur une zone corporelle contaminée doit se faire avec précaution. Une nouvelle chirurgie pourrait être nécessaire en présence de signes d’infection ou de développement d’un abcès au site d’application d’Arista™ AH afin de permettre le drainage.
L’innocuité et l’efficacité du produit dans le cadre d’interventions neurochirurgicales et ophtalmiques n’ont pas été déterminées.
L’Arista™ AH ne doit pas servir au contrôle des saignements après un accouchement ou des ménorragies.
PRÉCAUTIONS
Lorsque l’Arista™ AH est utilisé conjointement avec des circuits de récupération de sang autologue, suivez attentivement les directives données dans la section Administration du mode d’emploi concernant l’exécution d’une filtration appropriée et d’un lavage cellulaire.
L’Arista™ AH a été conçu pour être utilisé à l’état sec. Un contact préalable à l’application et à l’atteinte de l’hémostase avec une solution saline ou antibiotique entraînera une perte de potentiel hémostatique.
L’utilisation d’Arista™ AH n’est pas recommandée pour le traitement primaire des troubles de la coagulation.
Aucun essai n’a été réalisé pour vérifier l’utilisation d’Arista™ AH sur les surfaces osseuses sur lesquelles des matières prothétiques doivent être fixées avec un adhésif; une telle utilisation n’est donc pas recommandée.
L’Arista™ AH est livré stérile et ne peut pas être stérilisé à nouveau. Tout contenant d’Arista™ AH ouvert et inutilisé doit être éliminé.
N’appliquez pas d’Arista™ AH en quantités excédant 50 g chez un patient diabétique; il a été calculé qu’une quantité excédant 50 g pourrait avoir un impact sur la charge glycémique.
L’Arista™ AH ne doit pas être laissé dans le bassin rénal ni dans les uretères lors des interventions urologiques visant l’élimination des foyers potentiels de formation de calculs.
RÉACTIONS INDÉSIRABLES
Aucun des événements indésirables survenus au cours d’un essai clinique prospectif randomisé à contrôle concurrent n’a été jugé comme étant lié à l’usage de l’Arista™ AH par le comité de surveillance de la sécurité des données. Les événements indésirables les plus fréquents se sont avérés être des douleurs liées à la chirurgie, une anémie, des nausées, des valeurs d’analyses de laboratoire hors des plages normales, de l’arythmie, de la constipation, de la défaillance respiratoire et de l’hypotension. Tous ces événements ont été signalés dans une proportion supérieure à 10 % chez les patients traités avec l’Arista™ AH. Les détails des événements indésirables survenus au cours de cet essai clinique peuvent être consultés dans le mode d’emploi accompagnant le produit; ils sont également disponibles sur le site www.bd.com.
Mise en garde : La loi fédérale (des États-Unis) restreint la vente de ce dispositif par ou sur ordonnance d’un médecin agréé ou d’un praticien dûment agréé.
BD-14602
-
Les agents hémostatiques BD se présentent sous des formes diverses utilisables dans une multitude d’applications chirurgicales. Ils sont tous destinés à accélérer le processus naturel de coagulation. Ils sont aisément utilisables avec les applicateurs préchargés et les produits prêts à l’emploi.
-
Nous proposons une gamme complète de produits chirurgicaux
Littérature
Le corpus de publications de BD sur le secteur et nos offres vous donne des informations que vous pouvez utiliser pour continuer à viser l’excellence.
En savoir plus
Événements
BD contribue au secteur de la santé en proposant des produits et des services de pointe ayant pour but d'améliorer la qualité des soins tout en diminuant les coûts. Nous organisons des événements et participons à des rencontres qui excellent à faire progresser le monde de la santé, conformément à notre devise « advancing the world of health™ ».
En savoir plus
true
Les bases des particules hémostatiques absorbables Arista™ AH
- Les agents hémostatiques topiques incluent des agents agissant en tant que barrière mécanique contre le saignement et fournissent une matrice physique pour la coagulation, des agents biologiquement actifs qui catalysent la coagulation, et les thérapies combinées. 2
- Les agents hémostatiques peuvent améliorer la formation des caillots et la cicatrisation des plaies, et peuvent être utiles pour contrôler ou prévenir les saignements gênants lors d’interventions chirurgicales lorsque les méthodes d’hémostase classiques sont inadéquates.2
- AH est un agent hémostatique en poudre absorbable conçu pour être utilisé sur les sites de plaies chirurgicales, pour contrôler le saignement. Il s’agit d’une fine poudre blanche, sèche, stérilisée, biocompatible et apyrogène, généralement absorbée en 24 à 48 heures.
- Arista™ AH est une poudre hémostatique chirurgicale absorbable d’origine végétale à 100 %, dérivée d’amidon végétal purifié. La puissance d’Arista™ AH repose sur ses hémosphères polysaccharidiques microporeuses, une technologie brevetée de coagulation sanguine. Les sphères, composées de particules microporeuses dont la taille des pores est contrôlée, sont conçues pour agir en tant que tamis moléculaire. La puissante action osmotique déshydrate et gélifie le sang au contact afin d’accélérer le processus de coagulation naturel.
Fonctionnement et utilisation d’Arista™ AH
- L’acronyme « RAPID » peut être utilisé pour mémoriser les étapes de l’application :
- R (Retirer) : Retirer tout sang d’accès
- A (Appliquer) : Appliquer généreusement Arista™ AH sur le site de saignement
- P (Pression) : Exercer une pression convenant à la plaie jusqu’à l’atteinte de l’hémostase
- I (Irriguer) : Irriguer et retirer tout excédent d’Arista™ AH du site
- D (Done ou terminer) : L’hémostase est atteinte, rapidement, de manière sûre et efficace
- Avec l’applicateur par pulvérisation FlexiTip™, l’application précise et directe d’Arista™ AH se fait de façon simple et rapide. Le système de distribution se compose d’un dispositif en plastique léger et d’un long tube souple. Les embouts d’applicateur à portée étendue FlexiTip™ et FlexiTip™ XL assurent une application précise et exacte de la poudre hémostatique Arista™ AH à l’aide d’un dispositif simple à usage unique.1
- Application d’Arista : reportez-vous au mode d’emploi 1
- Mode d’emploi :
- Épongez, essuyez ou aspirez le tissu saignant. Il est important d’éliminer l’excès de sang afin qu’Arista™ AH puisse être appliqué immédiatement et directement sur le site de saignement actif.
- Positionnez l’embout de l’applicateur le plus près possible de la source de saignement. Appliquez immédiatement une quantité généreuse d’Arista™ AH sur le site de saignement dans la plaie pour recouvrir complètement la plaie. Des plaies profondes peuvent nécessiter l’application d’Arista™ AH à une profondeur égale. Afin de réduire l’occlusion de l’embout, exercez une pression pour appliquer Arista™ AH lorsque l’applicateur pénètre dans la plaie.
- Exercez rapidement une pression directe adaptée à la blessure sur le site traité. L’utilisation d’un substrat non adhérent afin d’exercer cette pression peut empêcher l’adhérence du caillot au gant chirurgical ou aux autres instruments. Le degré et la durée de la pression dépendent de la blessure. En cas de suintement, il n’est pas toujours nécessaire d’exercer une pression. En cas de blessure saignant abondamment, la pression doit être maintenue plus longtemps.
- Si le saignement ou le suintement persistent, retirez l’excès d’Arista™ AH et réappliquez.
- Si un matériau autre que l’Arista™ AH lié au caillot (c’est-à-dire, le pansement chirurgical) adhère au site de la plaie, irriguez le matériau avec une solution saline et le retirer avec précaution du site traité.
- Immédiatement après le contact avec du sang ou un liquide, l’Arista™ AH gonfle jusqu’à environ cinq fois son volume initial. Une fois l’hémostase atteinte, évacuez l’excès d’Arista™ AH ou Arista™ Plus par irrigation ou aspiration. Évitez l’irrigation en cas d’aspiration directe du caillot sanguin formé.1
- Administration : Appliquez une quantité généreuse d’Arista™ AH sur le site de saignement (voir le MODE D’EMPLOI), puis exercez une pression jusqu’à obtention de l’hémostase. Une fois l’hémostase atteinte, l’Arista™ AH doit être éliminé par irrigation ou aspiration.1
Voici des exemples d’interventions chirurgicales dans lesquelles Arista™ AH peut être utilisé :
- cardiothoraciques et cardiovasculaires
- vasculaires
- gynécologiques
- urologiques
- orthopédiques
- générales
- esthétiques
- auriculaires
- nasales
- ORL (gorge)
Avantages d’Arista™ AH
- Un grand nombre d’agents hémostatiques topiques ont été approuvés à titre de thérapies d’appoint pour le maintien de l’hémostase lors d’interventions chirurgicales au cours desquelles les méthodes conventionnelles sont insuffisantes ou non pratiques.2
- Avantages financiers potentiels en termes de prévention de l’utilisation ultérieure des ressources de l’hôpital pour gérer les saignements chirurgicaux. Outre d’autres stratégies de gestion du sang pour les patients, l’utilisation peropératoire d’agents hémostatiques topiques peut réduire la nécessité de transfuser des produits sanguins (p. ex. culots globulaires, plaquettes, plasma frais congelé) et réduire la durée des soins postopératoires (durée d’hospitalisation), chacun de ces éléments étant associé à des coûts substantiels.2
Utilisation simple
- Prêt sur demande
- Il suffit de retirer le bouchon et d’appliquer la poudre directement sur le point de saignement
- Aucun mélange ni aucune réfrigération nécessaires
- Durée de conservation de cinq ans4
Sûr et sans thrombine
- Synthétisé à partir d’amidon végétal purifié
- Sans thrombine, biocompatible et apyrogène
- Généralement absorbé et éliminé dans les 24 à 48 heures par les amylases
- Arista™ AH est le seul agent hémostatique disponible actuellement approuvé pour sa compatibilité avec l'épargne cellulaire1,6,7
Agent hémostatique efficace
- Le processus de coagulation débute au contact, peu importe le statut de coagulation du patient
- Atteinte de l’hémostase complète en seulement quelques minutes5
- Grande surface de couverture
Résultats et études de cas sur Arista™ AH
Essai clinique d’approbation avant commercialisation (général, orthopédique, cardiaque)
Cardiaques et vasculaires :
- Bruckner et al. (2014) Microporous polysaccharide hemosphere absorbable hemostat use in cardiothoracic surgical procedures
- Reynbakh et al. (2018) Use of MPH hemostatic powder for electrophysiology device implantation reduces postoperative rates of pocket hematoma and infection
- Bruckner and Loebe (2012a) Microporous polysaccharide hemosphere absorbable hemostat (AristaAH) use in re-operative cardiac surgical procedures.
- Bruckner and Loebe (2012b) The use of an absorbable microporous polysaccharide hemosphere haemostat (AristaAH) in ventricular assist device implant and cardiac transplantation procedures.
- Benlier et coll. (2007) Microvascular anastomosis with minimal suture and arista: An experimental study
ORL :
- Antisdel et coll. (2011) Microporous polysaccharide hemospheres do not increase synechiae after sinus surgery: Randomized controlled study
- Antisdel et coll. (2009a) Effect of hemostatic Agent MPH on bleeding after endoscopic sinus surgery: A prospective randomized controlled study
- Antisdel et coll. (2016) Product comparison model in otolaryngology: Equivalency analysis of absorbable hemostatic agents after endoscopic sinus surgery
- Phillips (2013) Safety and efficacy of Arista powder in 514 nasal septal and sinus surgery patients
- Sindwani (2009) Use of novel hemostatic powder MPH for endoscopic sinus surgery: Initial impressions
- Antisdel et coll. (2008) Hemostatic agent Microporous Polysaccharide Hemospheres (MPH) does not affect healing or intact sinus mucosa
Généraux :
- Egeli et coll. (2012) Microporous polysaccharide hemospheres and seroma formation after mastectomy and axillary dissection in rats
- Humphreys et coll. (2008a) Microporous polysaccharide hemospheres for management of laparoscopic trocar injury to the spleen
- Humphreys et coll. (2008b) Renal injury and the application of polysaccharide hemospheres: A laparoscopic experimental model
- Hoffmann et coll. (2009) Choice of Hemostatic Agent Influences Adhesion Formation in a Rat Cecal Adhesion Mode
- Ereth et coll. (2009) Microporous polysaccharide hemospheres do not enhance abdominal infection in a rat model compared with gelatin matrix
Urologiques
- Nunez-Nateras et coll. (2013) Athermal nerve sparing robot-assisted radical prostatectomy: Initial experience with microporous polysaccharide hemospheres as a topical hemostatic agent
- Gilbert et coll. (2016) Evaluation of Absorbable Hemostatic Powder for Prevention of Lymphoceles Following Robotic Prostatectomy With Lymphadenectomy
- Murat et coll. (2006) Evaluation of microporous polysaccharide hemospheres for parenchymal hemostasis during laparoscopic partial nephrectomy in the porcine model
- Mode d’emploi d’Arista™ AH
- Gabay, M. & Boucher, B.A. Une amorce essentielle pour comprendre le rôle des agents hémostatiques topiques, de produits à sceller chirurgicaux et des adhésifs pour le maintien de l’hémostase. Pharmacothérapie 33, 935-955 (2013).
- L’innocuité et l’efficacité cliniques d’Arista™ AH n’ont pas été testées chez les enfants et les femmes enceintes. Les données montrent que les nouveaux-nés et les bébés de moins de 10 mois peuvent présenter une activité inférieure des amylases; le taux de résorption d’ARISTA™ AH dans cette population pourrait donc excéder 48 heures.
- Données archivées
- Étude clinique ARISTA™ AH PMA P050038
- Données de BD archivées. Données précliniques peuvent ne pas être corrélés à la performance clinique chez les humains.
- Si Arista™ AH est utilisé conjointement avec des circuits de récupération du sang autologue, un réservoir de cardiotomie de 40 µ, un lavage cellulaire et un filtre de transfusion de 40 µ sont requis.
BD-53859
true
true