
- Übersicht
- Klinische Erfahrung
- EIFU & weitere Informationen
Der beschichtete Stent ist maßgeschneidert für AV-Patienten
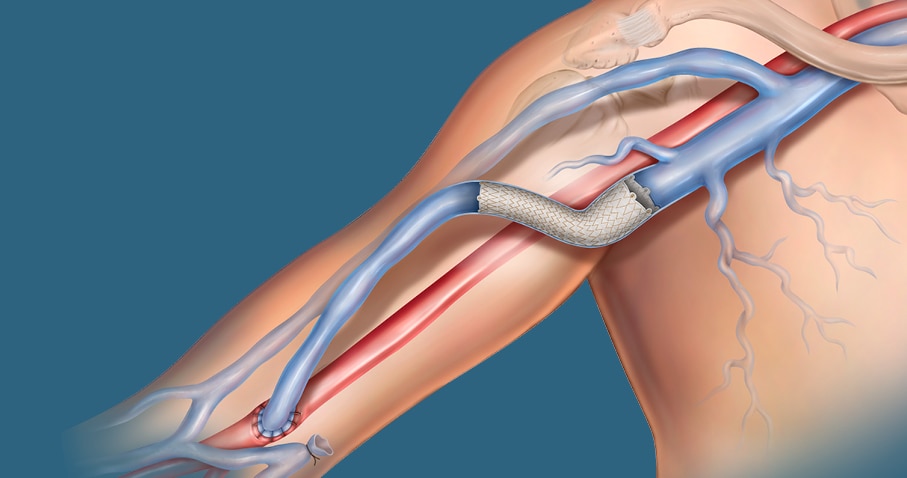
Der Covera™ beschichtete Gefäßstent baut auf bewährten Technologien des führenden Anbieters für den AV-Zugang auf. Diese beschichtete Stentplattform ist so konzipiert, dass sie die erforderliche Flexibilität und Festigkeit bietet, die für die Behandlung schwieriger Läsionen vom terminalen Kopfbogen über die basilischen Swingpoint-Segmente bis zur venösen AV-Anastomose erforderlich sind. Aufgeweitete und gerade Konfigurationen ermöglichen eine präzise Größenbestimmung und Anpassung an die Gefäßwand, während ein einfach zu bedienendes Daumenrad-Einführsystem mit zwei Geschwindigkeitsoptionen die Kontrolle über die Positionierung ermöglicht.
Der Covera™ beschichtete Gefäßstent lieferte in zwei separaten klinischen Studien effektive Ergebnisse, eine für Dialysepatienten mit AV-Shunts und eine für Dialysepatienten mit AV-Fisteln.1
Für Radialkraft und Flexibilität
Einzigartige, flexible Basisstent-Architektur, die für die Anpassung an das native Gefäß bei schwierigen AV-Anatomien entwickelt wurde.


- Die ausgestellte Konfiguration ist für Anatomien bestimmt, bei denen der Durchmesser des Abflussgefäßes größer ist als der des Zuflussgefäßes
- Die gerade Konfiguration ist für Anatomien bestimmt, bei denen der Durchmesser des Abflussgefäßes gleich dem oder kleiner ist als der des Zuflussgefäßes

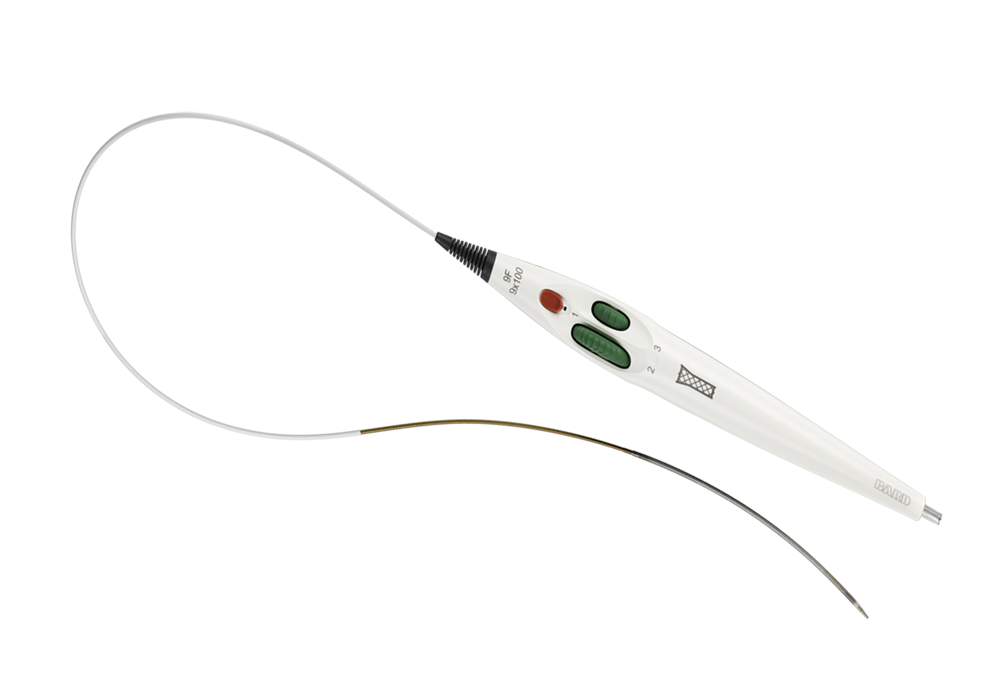
Atraumatische Spitze für einfaches Einführen und Entfernen an der Zugangsstelle
Erleichtert die genaue Kontrolle der Positionierung
Intuitives triaxiales Einführsystem für eine präzise Positionierung und optimale Läsionsabdeckung
*** In den USA, Stand Januar 2023
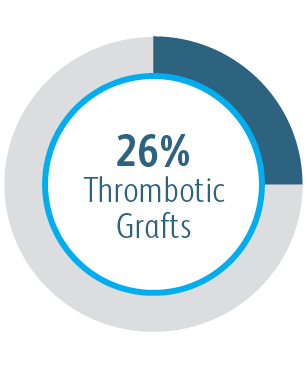
1 Dolmatch B, Waheed U, Balamuthusamy S, Hoggard J, Settlage R; AVeVA Trial Investigators. Prospective, Multicenter Clinical Study of the Covera Vascular Covered Stent in the Treatment of Stenosis at the Graft-Vein Anastomosis of Dysfunctional Hemodialysis Access Grafts. J Vasc Interv Radiol. 2022;33(5):479-488.e3. doi:10.1016/j. jvir.2022.02.008. AVeNEW Clinical Studies data on file. Nach 6 Monaten betrug die primäre Durchgängigkeit der Zielläsion (TLPP) in der AVeVA 70,3 % (proportionale Analyse). Nach sechs Monaten in der AVeNEW lag der TLPP-Wert für den Covera™ beschichteten Gefäßstent bei 78,7 % im Vergleich zu 47,9 % für PTA allein, p < 0,001. 130 der 142 (91,5 %) Studienteilnehmer, die in die Covera™ Gefäßstent-Gruppe randomisiert wurden, und 123 der 138 (89,1 %), die zur PTA randomisiert wurden, schlossen ihre Nachbeobachtung nach 6 Monaten ab. TLPP wird definiert als das Intervall nach dem Indexeingriff bis zur nächsten klinisch-indizierten Reintervention an oder in der Nähe der ursprünglichen Behandlungsstelle oder bis die Extremität für einen dauerhaften Zugang aufgegeben wurde. In der AVeNEW-Studie TLPP nach 6 Monaten – die Untergruppenanalyse wird als Beobachtungsdaten ohne p-Werte angegeben. In der AVeNEW-Studie kam es bei Patienten, die den Covera™ beschichteter Gefäßstent erhielten, nach 24 Monaten zu 103 Reinterventionen mit einer neuen Läsion, verglichen mit 72 Reinterventionen in der Gruppe, die nur mit PTA behandelt wurde. Nach 30 Tagen betrug der Anteil der Patienten ohne primäre Sicherheitsereignisse 96,4 % in AVeVa und 95,0 % (Covera™ beschichteter Gefäßstent) im Vergleich zu 96,4 % (nur PTA) bei AVeNEW (p < 0,0022). Das Nichtauftreten von primären Sicherheitsereignissen wurde definiert als Nichtvorhandensein von unerwünschten Ereignissen im Zusammenhang mit dem Zugangskreislauf, die zu einer zusätzlichen Intervention, einer Operation, einem Krankenhausaufenthalt oder zum Tod führen.
Bitte ziehen Sie die Produktkennzeichnung und -beileger zu Rate, um sich über Indikationen, Kontraindikationen, Risiken, Warnhinweise, Vorsichtsmaßnahmen und die richtige Handhabung zu informieren.
BD-23522v2
Der Covera™ beschichtete Gefäßstent wurde für die Behandlung schwieriger Läsionen im AV-Zugangskreislauf entwickelt, einschließlich des terminalen Kopfbogens, der basilischen Swingpoint-Segmente und der venösen AV-Anastomose.
Der Covera™ beschichtete Gefäßstent lieferte in zwei separaten klinischen Studien effektive Ergebnisse, eine für Dialysepatienten mit AV-Shunts und eine für Dialysepatienten mit AV-Fisteln, die beide die Vorteile des innovativen Stentdesigns aufzeigten.1
Die AVeVA-Studie war eine prospektive, nicht randomisierte, einarmige, multizentrische Studie zum Covera™ beschichteten Gefäßstent zur Behandlung von Stenosen an der Anastomose eines arteriovenösen Shunts und einer Ausflussvene. 110 Patienten wurden an 14 Prüfzentren in den USA mit dem Covera™ beschichteten Gefäßstent behandelt.
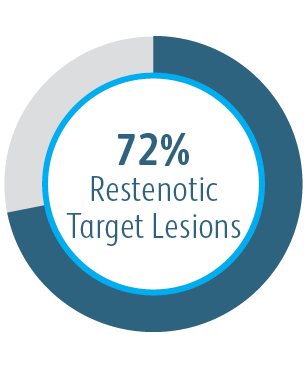
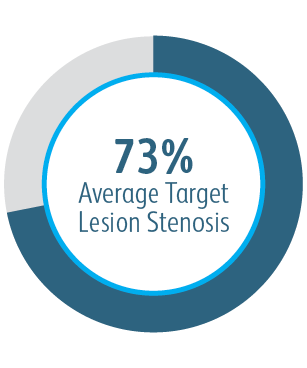
Die klinische AVeVA-Studie hat gezeigt, dass der Covera™ beschichtete Gefäßstent eine effektive Behandlung von Stenosen an der Graft-Venen-Anastomose von Patienten darstellt, die mit einem AV-Shunt dialysiert werden.
| Studiendesign | Prospektiv, nicht randomisiert, multizentrisch, einarmig |
| Ziel | Beurteilung der Sicherheit und Wirksamkeit des Covera™ beschichteten Gefäßstents bei der Behandlung von stenotischen Läsionen an der Graft-Venen-Anastomose von Hämodialysepatienten, die mit einem AV-Shunt dialysiert werden |
| Status | Follow-up nach 24 Monaten abgeschlossen |
| Anzahl der Patienten/Prüfzentren | 110 Patienten wurden an 14 Prüfzentren in den USA mit dem Covera™ beschichteten Gefäßstent behandelt. |
| Primärer Wirksamkeitsendpunkt | Primäre Durchgängigkeit der Zielläsion (TLPP): 6 Monate |
| Primärer Sicherheitsendpunkt | Nichtvorhandensein von unerwünschten Ereignissen im Zusammenhang mit dem Zugangskreislauf, die innerhalb von 30 Tagen zu einer zusätzlichen Intervention, einer Operation, einem Krankenhausaufenthalt oder zum Tod führen. |
| Follow-Up | 30 und 90 Tage; 6, 12, 18 und 24 Monate |
Primäre Durchgängigkeit der Zielläsion (TLPP) 6 Monate nach Behandlung von AV-Shunt Anastomosen-Stenosen mit BD Stentgrafts
Dieses Diagramm dient nur Schulungszwecken und nicht Vergleichszwecken. Unterschiede im Studiendesign können sich auf die Ergebnisse auswirken. Einzelheiten zum Studiendesign finden Sie in den vollständigen Manuskripten.
In der klinischen AVeVA-Studie wurde der Covera™ beschichte Gefäßstent in einer herausfordernden Patientenkohorte untersucht.
| Studiendesign | Prospektiv, multizentrisch, randomisiert, gleichzeitig kontrolliert |
| Ziel | Beurteilung der Sicherheit und Wirksamkeit des Covera™ beschichteten Gefäßstents bei der Behandlung von stenotischen Läsionen im venösen Abfluss der oberen Extremitäten des AV-Zugangskreislaufs von Hämodialysepatienten, die mit einer AV-Fistel dialysiert werden |
| Status | Follow-up nach 24 Monaten abgeschlossen |
| Anzahl der Patienten/Prüfzentren | 280 randomisierte Studienteilnehmer an 24 Prüfzentren (USA, EU und ANZ) |
| Primärer Wirksamkeitsendpunkt | Primäre Durchgängigkeit der Zielläsion (TLPP): 6 Monate |
| Primärer Sicherheitsendpunkt | Keine schwerwiegenden prüfplandefinierten Sicherheitsereignisse im Zusammenhang mit dem AV-Zugangskreislauf über 30 Tage |
| Follow-Up | Bei Krankenhausentlassung, 30 und 90 Tage; 6, 12, 18 und 24 Monate |
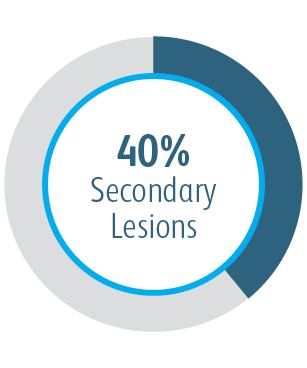
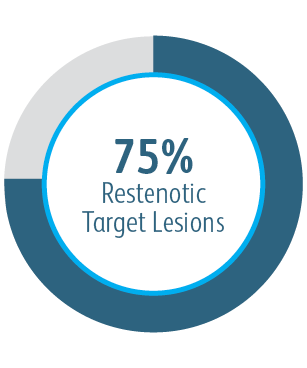
In der klinischen AVeNEW-Studie wurde der Covera™ beschichtete Gefäßstent bei der Behandlung einer herausfordernden Patientenpopulation mit schwierigen Läsionseigenschaften verwendet.
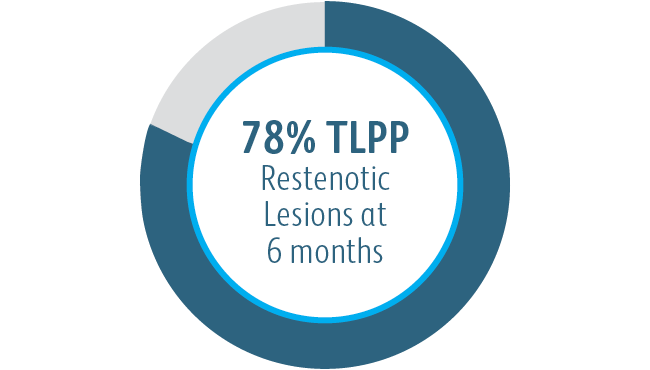
Der Covera™ beschichtete Gefäßstent war bei der Behandlung von Stenosen im venösen Abfluss von Dialysepatienten mit einer arteriovenösen Fistel nach 6 und 12 Monaten der PTA-Kontrolle überlegen.
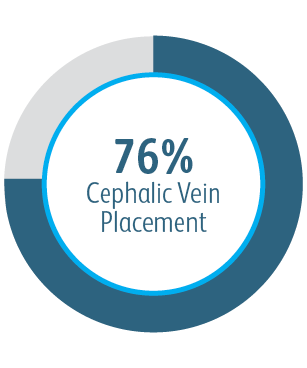
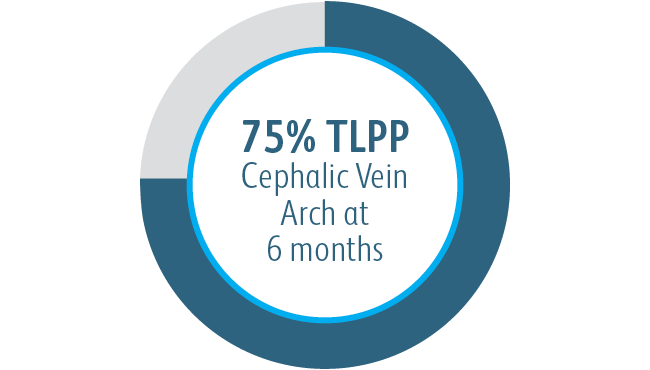
Alle Untergruppen zeigten nach 6 Monaten einen Nutzen
In allen analysierten Untergruppen der Zielläsionsstelle zeigte der Covera™ beschichtete Gefäßstent eine größere primäre Durchgängigkeit der Zielläsion im Vergleich zur PTA allein, einschließlich derjenigen, die am Bogen der V. cephalica behandelt wurden.
Klinische AVeNEW-Studie – Weitere Endpunkte
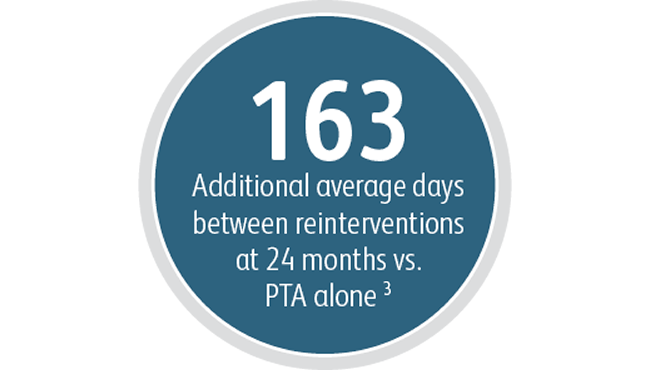
Neben den Vorteilen bei der primären Durchgängigkeit der Zielläsion zeigte der Covera™ beschichtete Gefäßstent ein hohes Maß an akutem technischem Erfolg und verlängerte die durchschnittliche Zeitspanne zwischen den Interventionen an der Zielläsion im Vergleich zur PTA allein.
In der klinischen AVeNEW-Studie wurden 77 Patienten mit Stenosen im Bogen der V. cephalica mit dem
Covera™ beschichteten Stent behandelt.
Dieses Fallbeispiel zeigt die Baseline-Angiografie, die die Gefäßverengung darstellt, sowie den akuten technischen Erfolg bei der Wiederherstellung des Gefäßes und die Anpassungsfähigkeit des beschichteten Stents.
* Haskal ZJ, Trerotola S, Dolmatch B, et al. Stent graft versus balloon angioplasty for failing dialysis-access grafts. N Engl J Med. 2010 Feb 11;362(6):494-503.
** Haskal ZJ, Saad TF, Hoggard JG, et al. Prospective, randomized, concurrently-controlled study of a stent graft versus balloon angioplasty for treatment of arteriovenous access graft stenosis: 2-year results of the RENOVA study. J Vasc Interv Radiol. 2016 Aug;27(8):1105-1114.e3.
*** In den USA ab November 2022
1 Dolmatch B, Waheed U, Balamuthusamy S, Hoggard J, Settlage R; AVeVA Trial Investigators. Prospective, multicenter clinical study of the Covera Vascular Covered Stent in the treatment of stenosis at the graft-vein anastomosis of dysfunctional hemodialysis access grafts. J Vasc Interv Radiol. 2022;33(5):479-488.e3. doi:10.1016/j. jvir.2022.02.008. AVeNEW Clinical Studies data on file. Nach 6 Monaten betrug die primäre Durchgängigkeit der Zielläsion (TLPP) in der AVeVA 70,3 % (proportionale Analyse). Nach sechs Monaten in der AVeNEW lag der TLPP-Wert für den Covera™ beschichteten Gefäßstent bei 78,7 % im Vergleich zu 47,9 % für PTA allein, p < 0,001. 130 der 142 (91,5 %) Studienteilnehmer, die in die Covera™ Gefäßstent-Gruppe randomisiert wurden, und 123 der 138 (89,1 %), die zur PTA randomisiert wurden, schlossen ihre Nachbeobachtung nach 6 Monaten ab. TLPP wird definiert als das Intervall nach dem Indexeingriff bis zur nächsten klinisch-indizierten Reintervention an oder in der Nähe der ursprünglichen Behandlungsstelle oder bis die Extremität für einen dauerhaften Zugang aufgegeben wurde. In der AVeNEW-Studie TLPP nach 6 Monaten – Die Untergruppenanalyse wird als Beobachtungsdaten ohne p-Werte angegeben. In der AVeNEW-Studie kam es bei Patienten, die den Covera™ beschichteter Gefäßstent erhielten, nach 24 Monaten zu 103 Reinterventionen mit einer neuen Läsion, verglichen mit 72 Reinterventionen in der Gruppe, die nur mit PTA behandelt wurde. Nach 30 Tagen betrug der Anteil der Patienten ohne primäre Sicherheitsereignisse 96,4 % in AVeVa und 95,0 % (Covera™ beschichteter Gefäßstent) im Vergleich zu 96,4 % (nur PTA) bei AVeNEW (p < 0,0022). Das Nichtauftreten von primären Sicherheitsereignissen wurde definiert als Nichtvorhandensein von unerwünschten Ereignissen im Zusammenhang mit dem Zugangskreislauf, die zu einer zusätzlichen Intervention, einer Operation, einem Krankenhausaufenthalt oder zum Tod führen.
2 Der akute technische Erfolg war definiert als die nach Meinung des Operateurs erfolgreiche Freisetzung des Implantats an der vorgesehenen Stelle, die zum Zeitpunkt des Indexverfahrens beurteilt wurde. AVeNEW Klinische Studie. Daten im Archiv. Bard Peripheral Vascular Inc., Tempe, AZ.
3 Index Durchgängigkeitsfunktion – Zielläsion (IPF-T) ist definiert als die Zeit vom Indexstudienverfahren bis zum Abschluss der Studie oder der vollständigen Aufgabe des Zugangs geteilt durch die Anzahl der Termine für einen erneuten Eingriff, der an der Zielläsion durchgeführt wurde, um den Gefäßzugang für die Hämodialyse aufrechtzuerhalten. Mittlerer IPF-T von 380,40 Tagen mit dem Covera™ beschichteten Gefäßstent vs. 217,57 Tage mit PTA allein nach 24 Monaten. AVeNEW Klinische Studie. Daten im Archiv. Bard Peripheral Vascular Inc., Tempe, AZ.
Bitte ziehen Sie die Produktkennzeichnung und -beileger zu Rate, um sich über Indikationen, Kontraindikationen, Risiken, Warnhinweise, Vorsichtsmaßnahmen und die richtige Handhabung zu informieren.
BD-23522v2
Hier finden Sie eine hilfreiche Sammlung weiterer Informationsmaterialien zu Ihrer Verfügung.
BD ist Gastgeber und Teilnehmer von Veranstaltungen, die Forschritt für die Welt der Gesundheit™ bringen.