Covera™
Krytý vaskulární stent
JEDINÝ krytý stent indikovaný pro AV štěpy a nativní AV píštěl***

- Přehled
- Klinické zkušenosti
- Elektronický návod k použití a zdroje
Krytý stent na míru pro pacienty s AV
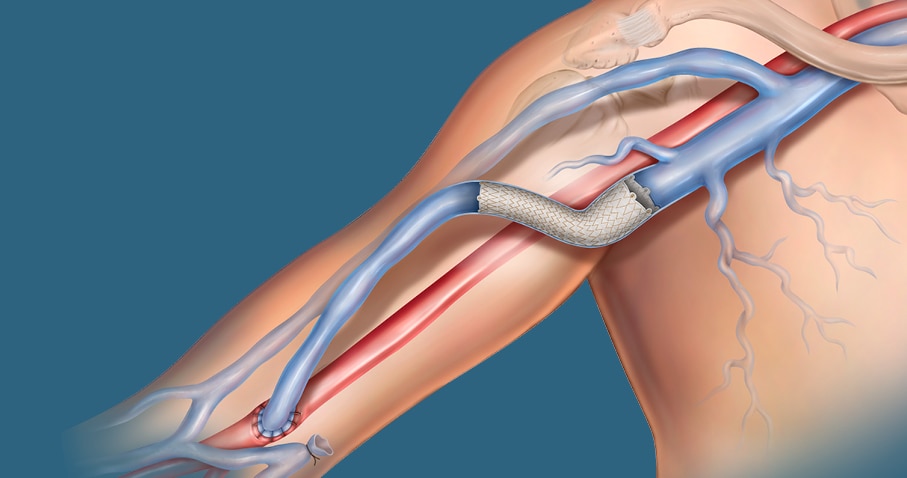
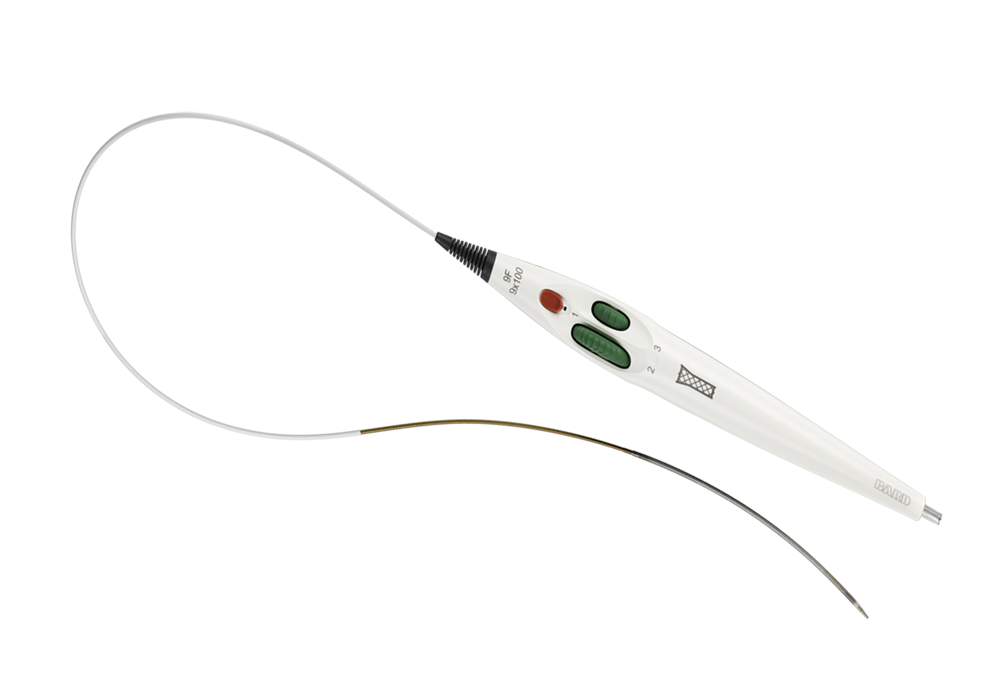
Systém vaskulárního krytého stentu Covera™ vychází z osvědčených technologií, které jsou jedničkou v oblasti AV přístupu. Tato platforma krytého stentu je navržena tak, aby vyvážila pružnost a sílu nutnou pro řešení náročných lézí od terminálního cefalického oblouku k bazilárnímu výkyvnému segmentu až po venózní anastomózu AV štěpu. Rozšířená a rovná konfigurace umožňují přesnou velikost a úpravu stěny cévy, zatímco snadno použitelný zaváděcí systém s ručním ovladačem se dvěma rychlostmi umožňuje ovládat umístění.
Vaskulární krytý stent Covera™ má účinné výsledky ve dvou samostatných klinických studiích, jeden pro pacienty s dialyzací AV štěpy a jeden pro pacienty s dialyzací AV píštělemi.1
Pro radiální pevnost a flexibilitu
Jedinečná flexibilní struktura základního stentu navržená tak, aby se přizpůsobil přirozené cévě při náročné anatomii AV.


- Rozšířená konfigurace je určena k použití v anatomických strukturách, kde je průměr odtokové cévy větší než průměr vtokové cévy
- Přímá konfigurace je určena k použití v anatomických strukturách, kde je průměr odtokové cévy roven nebo menší než průměr vtokové cévy

Atraumatický hrot navržený pro snadné zavedení a vyjmutí v místě vstupu
Usnadňuje přesnou kontrolu umístění
Intuitivní tříosý zaváděcí systém určený k přesnému umístění a optimálnímu pokrytí léze
*** V USA od ledna 2023
1 Dolmatch B, Waheed U, Balamuthusamy S, Hoggard J, Settlage R; AVeVA Trial Investigators. Prospective, Multicenter Clinical Study of the Covera Vascular Covered Stent in the Treatment of Stenosis at the Graft-Vein Anastomosis of Dysfunctional Hemodialysis Access Grafts. J Vasc Interv Radiol. 2022;33(5):479-488.e3. doi:10.1016/j. jvir.2022.02.008. Nepublikované údaje klinických studií AVeNEW. Za 6 měsíců byla primární průchodnost cílové léze AVeVA (TLPP) 70,3 % (proporcionální analýza). Za 6 měsíců u AVeNEW činil TLPP 78,7 % u vaskulárního krytého stentu Covera™ v porovnání s 47,9 % u samotných PTA, P < 0,001. 130 ze 142 (91,5 %) subjektů randomizovaných do skupiny vaskulárního stentu Covera™ a 123 ze 138 (89,1 %) randomizovaných do PTA dokončilo své 6měsíční sledování. TLPP je definován jako interval následující po indexové intervenci až do další klinicky řízené reintervence v původním místě léčby nebo vedle něj, nebo do doby, kdy byla končetina pro trvalý přístup opuštěna. U AVeNEW je "TLPP za 6 měsíců – analýza podskupin" poskytována jako pozorovací data bez hodnot P. U systému AVeNEW absolvovali pacienti, kteří obdrželi vaskulární krytý stent Covera™, 103 opakovaných zákroků zahrnujících novou lézi v porovnání se 72 opakovanými zákroky ve skupině pouze s PTA po 24 měsících. Po 30 dnech bylo bez primárních bezpečnostních událostí 96,4 % u AVeVa a 95,0 % (vaskulární krytý stent Covera™) oproti 96,4 % (pouze PTA) u AVeNEW (P < 0,0022). Nepřítomnost primárních bezpečnostních událostí byla definována jako stav bez výskytu nežádoucích účinků zahrnujících přístupový okruh s následnou další intervencí, chirurgickým zákrokem, hospitalizací nebo úmrtím.
Indikace použití, kontraindikace, varování, bezpečnostní opatření, komplikace, nežádoucí účinky a podrobné bezpečnostní informace naleznete v návodu k použití.
Vaskulární krytý stent Covera™ byl navržen pro řešení náročných lézí uvnitř AV přístupového okruhu, včetně terminálního cefalického oblouku, bazilárních výkyvných segmentů a anastomózy žilního štěpu.
Vaskulární krytý stent Covera™ má účinné výsledky ve dvou samostatných klinických studiích, jeden pro pacienty s dialyzací AV štěpy a jeden pro pacienty s dialyzací AV píštělemi, přičemž oba z nich prokázaly výhody inovativního designu stentu.1
AVeVA byla prospektivní, nerandomizovaná, jednoramenná, multicentrická studie vaskulárního krytého stentu Covera™ používaného k léčbě stenóz v anastomóze arteriovenózního štěpu a odtokové žíly. 110 pacientů bylo léčeno vaskulárním krytým stentem Covera™ na 14 výzkumných pracovištích v USA.
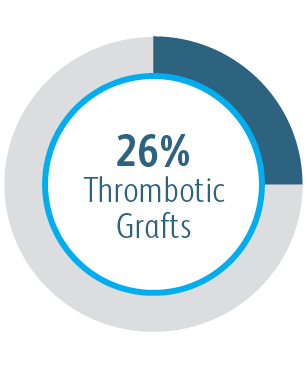
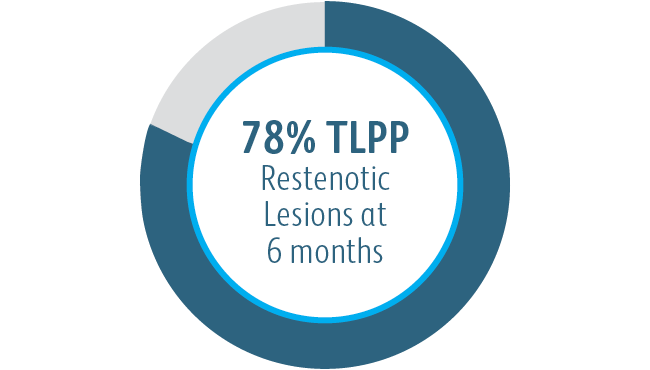
Klinická studie AVeVA prokázala, že vaskulární krytý stent Covera™ je účinný při léčbě stenóz v místě anastomózy žilního štěpu u pacientů s dialyzací AV štěpem.
| Návrh studie | Prospektivní, nerandomizovaná, multicentrická, jednoramenná |
| Cíl | Posouzení bezpečnosti a účinnosti vaskulárního krytého stentu Covera™ při léčbě stenotických lézí při anastomóze štěpu a žíly u pacientů s hemodialýzou dialyzující s AV štěpem |
| Stav | Následná kontrola po 24 měsících provedena |
| Počet pacientů/míst | 110 pacientů bylo léčeno vaskulárním krytým stentem Covera™ na 14 výzkumných pracovištích v USA |
| Primární koncový bod účinnosti | Primární průchodnost cílové léze (TLPP) – 6 měsíců |
| Primární cílový bod bezpečnosti | Nepřítomnost nežádoucích účinků zahrnujících přístupový okruh s následnou další intervencí, chirurgickým zákrokem, hospitalizací nebo úmrtím do 30 dnů |
| Následná kontrola | 30 a 90 dní; 6, 12, 18 a 24 měsíců |
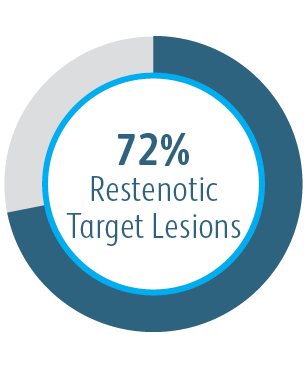
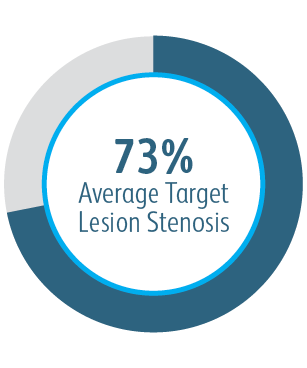
Primární průchodnost cílové léze po 6 měsících (TLPP) po léčbě anastmotických stenóz AV štěpů pomocí štěpů stentu BD
Tato tabulka je určena pouze pro vzdělávací účely, nikoli pro srovnání. Výsledky mohou být ovlivněny rozdíly v návrhu studie. Úplné podrobnosti o návrhu studie se nachází v úplné dokumentaci studie.
V klinické studii AVeVA byl vaskulární krytý stent Covera™ studován na náročné kohortě pacientů.
| Návrh studie | Prospektivní, multicentrická, randomizovaná, souběžně kontrolovaná |
| Cíl | Posouzení bezpečnosti a účinnosti vaskulárního krytého stentu Covera™ při léčbě stenotických lézí v žilním odtoku horní končetiny přístupového obvodu AV u pacientů s hemodialýzou dialyzující s AV píštělí |
| Stav | Následná kontrola po 24 měsících provedena |
| Počet pacientů/míst | 280 randomizovaných subjektů na 24 výzkumných pracovištích (USA, EU a Austrálie a Nový Zéland) |
| Primární koncový bod účinnosti | Primární průchodnost cílové léze (TLPP) – 6 měsíců |
| Primární cílový bod bezpečnosti | Nepřítomnost jakékoli závažné bezpečnostní události definované protokolem pro obvod přístupu AV po dobu 30 dnů |
| Následná kontrola | Při propuštění z nemocnice, 30 a 90 dní; 6, 12, 18 a 24 měsíců |
V klinické studii AVeNEW byl vaskulární krytý stent Covera™ použit k léčbě náročných pacientů s obtížnými charakteristikami léze.
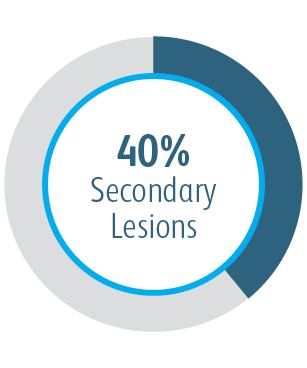
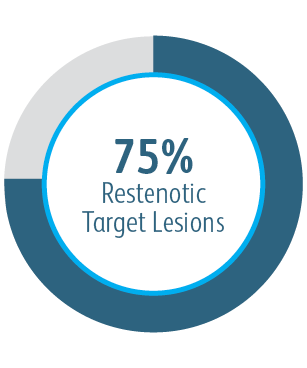
Vaskulární krytý stent Covera™ byl nadřazen kontrole PTA po 6 a 12 měsících s ohledem na TLPP při léčbě stenóz v žilním odtoku pacientů dialyzujících s arteriovenózní píštělí.
Všechny podskupiny vykazovaly po 6 měsících přínos
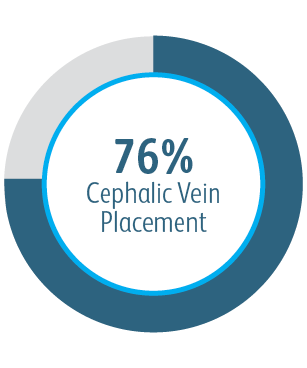
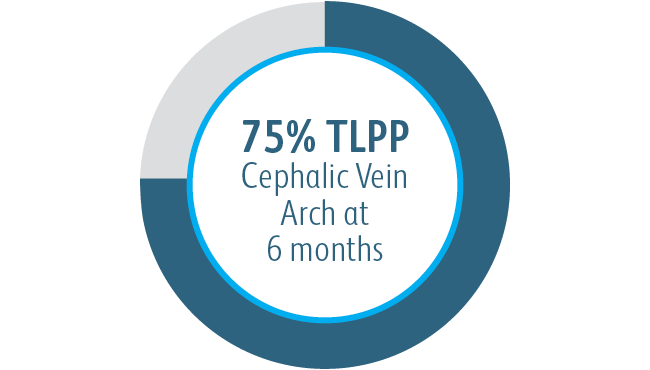
Ve všech analyzovaných podskupinách umístění cílové léze vykazoval vaskulární krytý stent Covera™ větší primární průchodnost cílové léze ve srovnání se samotným PTA, včetně těch léčených v oblouku v. cephalica.
Další cílové body klinické studie AVeNEW
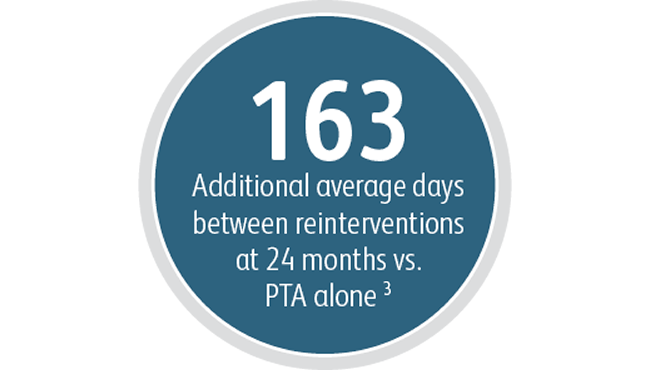
Kromě výhod primární průchodnosti cílové léze prokázal vaskulární krytý stent Covera™ vysoký stupeň akutní technické úspěšnosti a prodloužil průměrnou dobu mezi zákroky v cílové lézi ve srovnání se samotným PTA.
V klinické studii AVeNEW bylo 77 pacientů se stenózou v oblouku v. cephalica léčeno s
krytým stentem Covera™.
Tento příklad ukazuje základní angiografii zobrazující zúžení cévy a akutní technický úspěch s obnovením cévy a použitelnost krytého stentu.
* Haskal ZJ, Trerotola S, Dolmatch B, et al. Stent graft versus balloon angioplasty for failing dialysis-access grafts. N Engl J Med. 2010 Feb 11;362(6):494-503.
** Haskal ZJ, Saad TF, Hoggard JG, et al. Prospective, randomized, concurrently-controlled study of a stent graft versus balloon angioplasty for treatment of arteriovenous access graft stenosis: 2-year results of the RENOVA study. J Vasc Interv Radiol. 2016 Aug;27(8):1105-1114.e3.
***V USA k listopadu 2022
1 Dolmatch B, Waheed U, Balamuthusamy S, Hoggard J, Settlage R; AVeVA Trial Investigators. 5Prospective, multicenter clinical study of the Covera Vascular Covered Stent in the treatment of stenosis at the graft-vein anastomosis of dysfunctional hemodialysis access grafts. J Vasc Interv Radiol. 2022;33(5):479-488.e3. doi:10.1016/j. jvir.2022.02.008. Nepublikované údaje klinických studií AVeNEW. Za 6 měsíců byla primární průchodnost cílové léze AVeVA (TLPP) 70,3 % (proporcionální analýza). Za 6 měsíců u AVeNEW činil TLPP 78,7 % u vaskulárního krytého stentu Covera™ v porovnání s 47,9 % u samotných PTA, P < 0,001. 130 ze 142 (91,5 %) subjektů randomizovaných do skupiny vaskulárního stentu Covera™ a 123 ze 138 (89,1 %) randomizovaných do PTA dokončilo své 6měsíční sledování. TLPP je definován jako interval následující po indexové intervenci až do další klinicky řízené reintervence v původním místě léčby nebo vedle něj, nebo do doby, kdy byla končetina pro trvalý přístup opuštěna. U AVeNEW je "TLPP za 6 měsíců – analýza podskupin" poskytována jako pozorovací data bez hodnot P. U systému AVeNEW absolvovali pacienti, kteří obdrželi vaskulární krytý stent Covera™, 103 opakovaných zákroků zahrnujících novou lézi v porovnání se 72 opakovanými zákroky ve skupině pouze s PTA po 24 měsících. Po 30 dnech bylo bez primárních bezpečnostních událostí 96,4 % u AVeVa a 95,0 % (vaskulární krytý stent Covera™) oproti 96,4 % (pouze PTA) u AVeNEW (P < 0,0022). Nepřítomnost primárních bezpečnostních událostí byla definována jako stav bez výskytu nežádoucích účinků zahrnujících přístupový okruh s následnou další intervencí, chirurgickým zákrokem, hospitalizací nebo úmrtím.
2 Akutní technický úspěch byl definován jako úspěšné rozvinutí implantátu na základě názoru operatéra do zamýšleného místa vyhodnoceného v době indexační procedury. Klinická studie AVeNEW. Nepublikované údaje. Bard Peripheral Vascular Inc., Tempe, AZ.
3 Index funkce průchodnosti – cílová léze (IPF-T) je definována jako doba od zákroku v rámci indexové studie do dokončení studie nebo úplné zrušení přístupu děleno počtem návštěv pro opakovanou intervenci provedenou v cílové lézi za účelem zachování cévního přístupu pro hemodialýzu. Střední hodnota IPF-T 380,40 dne s krytým stentem Covera™ oproti 217,57 dnům při samotné PTA po 24 měsících. Klinická studie AVeNEW. Nepublikované údaje. Bard Peripheral Vascular Inc., Tempe, AZ.
Indikace použití, kontraindikace, varování, bezpečnostní opatření, komplikace, nežádoucí účinky a podrobné bezpečnostní informace naleznete v návodu k použití.
BD-23522v2