Klinická studie Arista™ AH PMA P050038.
Podrobné pokyny k aplikaci se nachází v úplných pokynech k použití.
Pokyny k použití Arista™ AH.
Zřeknutí se odpovědnosti
Ne všechny produkty, služby, nároky nebo funkce produktů musí být dostupné nebo platné ve vaší místní oblasti. Poraďte se s místním zástupcem společnosti BD.
Indikace, kontraindikace, nebezpečí, varování a bezpečnostní opatření jsou uvedeny na štítcích produktů a v pokynech k použití.
Indikace
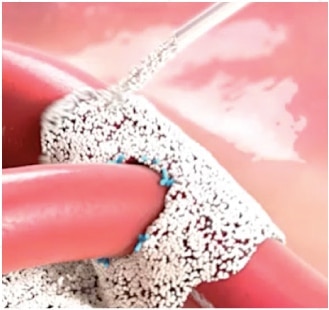
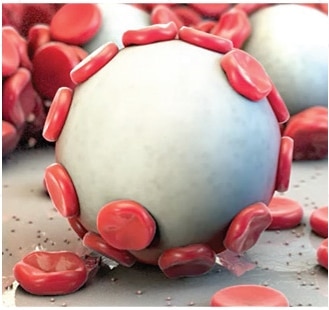
Arista™ AH je indikován k chirurgickým výkonům (s výjimkou oftalmologických) jako podpůrný hemostatický prostředek pro případy, kdy je kontrola kapilárního, venózního a arteriálního krvácení pomocí tlaku, ligatury a jiných konvenčních postupů neúčinná či nepraktická.
Kontraindikace
Nevstřikujte ani neumisťujte částice Arista™ AH do cév, protože může dojít k embolizaci a smrti.
Varování
Bezpečnost a účinnost Arista™ AH nebyla klinicky hodnocena u dětí, těhotných a/nebo kojících žen. * Vzhledem k tomu, že byly hlášeny případy snížené aktivity amylázy u novorozenců do 10 měsíců, rychlosti vstřebatelnosti Arista™ AH v této populaci může být delší než 48 hodin.
Jakmile je dosaženo hemostázy, přebytek Arista™ AH by měl být odstraněn z místa aplikace proplachováním a aspirací zejména při použití v foraminech kosti a kolem nich, oblastí kostního uzavřených, míchy a/nebo optického nervu a chiasmatis. Arista™ AH se zvětšuje na svůj maximální objem ihned po kontaktu s krví nebo jinými tekutinami. Suchý, bílý Arista™ AH by měl být odstraněn. Možnost, že produkt zasahuje do normální funkce a/nebo způsobí kompresní nekrózu okolních tkání v důsledku otoku, je snížena odstraněním přebytečného suchého materiálu.
Tento prostředek byl navržen pouze pro jednorázové použití. Opakované použití, resterilizace, opětovné zpracování nebo zabalení mohou narušit základní materiálové a konstrukční vlastnosti, které jsou nezbytné k celkové funkci prostředku, a mohou také vést k selhání prostředku s následným poškozením pacienta. Opakované použití, zpracování, sterilizace nebo balení mohou také znamenat riziko kontaminace prostředku a/nebo vést k infikování pacienta nebo křížové infekci, jako je například přenos infekčních onemocnění z jednoho pacienta na druhého. Kontaminace prostředku může vést k poranění, onemocnění nebo úmrtí pacienta nebo koncového uživatele.
Arista™ AH není určen jako náhrada pečlivé chirurgické techniky a řádné aplikace ligatur a ostatních konvenčních postupů pro hemostázu.
Bezpečnost a účinnost v očních zákrocích nebyla stanovena.
Arista™ AH by se neměl používat k řízení krvácení po porodu nebo menoragického krvácení.
Arista™ AH by měl být používán s opatrností v přítomnosti infekce nebo v kontaminovaných oblastech těla. Pokud se objeví známky infekce nebo abscesu v místě použití Arista™ AH, může být nutná opakovaná operace, aby byla umožněna drenáž.
Prostředek po použití zlikvidujte. Tento produkt může představovat potenciální biologické riziko. Zacházejte s prostředkem a likvidujte jej v souladu se zavedenou lékařskou praxí a platnými zákony a předpisy.
Bezpečnostní opatření
Tento prostředek by měli používat pouze lékaři obeznámení s vhodnými chirurgickými technikami.
Bezpečnost a účinnost použití u neurologických zákroků nebyla stanovena randomizovanými klinickými studiemi.
Pokud se Arista™ AH používá ve spojení s autologními okruhy pro záchranu krve, pečlivě dodržujte pokyny v části Podávání týkající se správné filtrace a mytí buněk.
Arista™ AH je určen k použití v suchém stavu. Kontakt s fyziologickým roztokem nebo antibiotickými roztoky před dosažením hemostázy povede ke ztrátě hemostatického potenciálu.
Arista™ AH se dodává jako sterilní prostředek a nelze jej opakovaně sterilizovat. Nepoužité, otevřené nádoby Arista™ AH by měly být zlikvidovány.
Neaplikujte více než 50 g Arista™ AH u diabetických pacientů, protože bylo vypočteno, že množství přesahující 50 g může ovlivnit glykémii.
Arista™ AH se nedoporučuje pro primární léčbu poruch koagulace.
U urologických zákroků by Arista™ AH neměl zůstat v ledvinné pánvičce nebo močovodu, aby se eliminovalo potenciální riziko tvorby kamene.
Nebylo provedeno žádné testování použití Arista™ AH na kostní povrchy, ke kterým mají být protetické materiály připevněny lepidly, a proto se nedoporučuje.
Nežádoucí reakce
V randomizované prospektivní, souběžně kontrolované klinické studii celkem 288 randomizovaných pacientů dostalo Arista™ AH nebo kontrolu (želatinová houba s trombinem nebo bez trombinu). Nejčastějšími zaznamenanými nežádoucími účinky byly bolest spojená s chirurgickým výkonem, anémií, nevolností a laboratorními hodnotami mimo normální rozsah. Následuje úplný seznam nežádoucích účinků hlášených u více než 5 % pacientů léčených Arista™ AH. Pro srovnání jsou uvedeny odpovídající nežádoucí účinky pro kontrolní skupinu. Žádné z nežádoucích účinků, ke kterým došlo, nebyly podle Komise pro sledování bezpečnosti dat posouzeny jako související s použitím Arista™ AH. Informace o indikacích, kontraindikacích, rizicích, varováních, bezpečnostních opatřeních a pokynech k použití najdete na štítcích výrobku a v přibaleném letáku.