Covera™
Powlekany stent naczyniowy
JEDYNY stent z powłoką przeznaczony do protez AV i natywnej przetoki AV***
- Przegląd
- Doświadczenie kliniczne
- EIFU i Zasoby
Powlekany stent na miarę dla pacjentów z AV
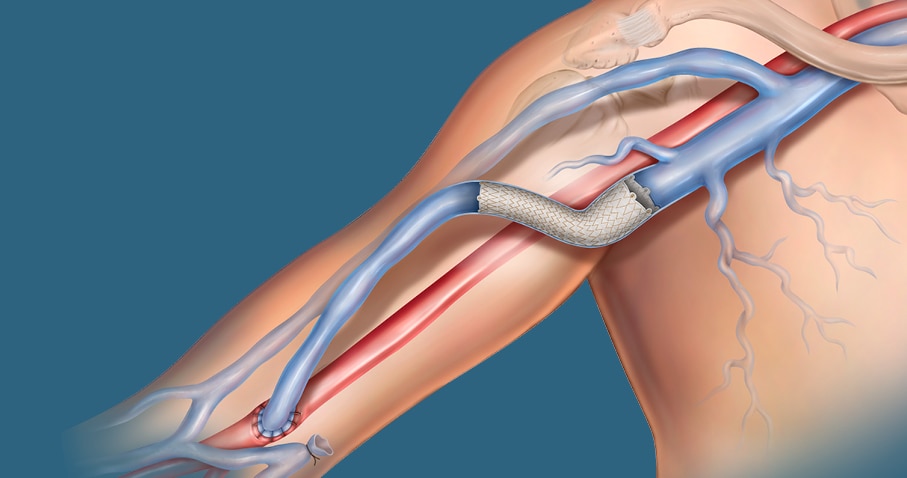
Powlekany stent naczyniowy Covera™ opiera się na sprawdzonych, cenionych technologiach w kategorii dostępów AV. Ten system stentu powlekanego zaprojektowano w taki sposób, aby uzyskać optymalny stosunek giętkości i wytrzymałości do leczenia problematycznych zmian, od końca łuku żyły odpromieniowej, przez przemieszczoną żyłę odłokciową, aż do zespolenia żylnego graftu AV. Konfiguracje kielichowa i prosta umożliwiają precyzyjne dobranie rozmiaru i dopasowanie do ściany naczynia, a łatwy w użyciu system wprowadzania z pokrętłem i z dwiema opcjami prędkości zapewnia kontrolę nad pozycjonowaniem.
Powlekany stent naczyniowy Covera™ uzyskał dobre wyniki skuteczności w dwóch oddzielnych badaniach klinicznych, jednym u pacjentów dializowanych przy użyciu protez AV i jednym u pacjentów dializowanych z przetoką AV1.
Wytrzymałość i giętkość w tętnicy promieniowej
Unikalna, elastyczna architektura stentu bazowego zaprojektowana tak, aby dopasować się do naczynia natywnego w trudnych warunkach anatomicznych AV.

- 1
- 2
- 3
- 4
- 5
Profilowane krawędzie zaprojektowane tak, aby zoptymalizować przyleganie do ścian i promować przepływ laminarny
Impregnacja węglem na całej długości kanału
Zaprojektowane pod kątem zginania, ściskania i skręcania, z helikalnymi rozpórkami i zagiętymi mostkami
Pełna enkapsulacja pomiędzy dwiema warstwami ePTFE, tak by przeciwdziałać rozrostowi neointimy w obszarze leczenia
Znaczniki tantalowe poprawiają widoczność pod kontrolą fluoroskopii

- Konfiguracja kielichowa jest przeznaczona do stosowania, gdy średnica naczynia odpływowego jest większa niż średnica naczynia dopływowego
- Konfiguracje proste są przeznaczone do stosowania, gdy średnica naczynia odpływowego jest mniejsza lub równa średnicy naczynia dopływowego

Atraumatyczna końcówka zaprojektowana w celu ułatwienia wprowadzania i wyjmowania w miejscu dostępu
Ułatwia dokładną kontrolę pozycjonowania
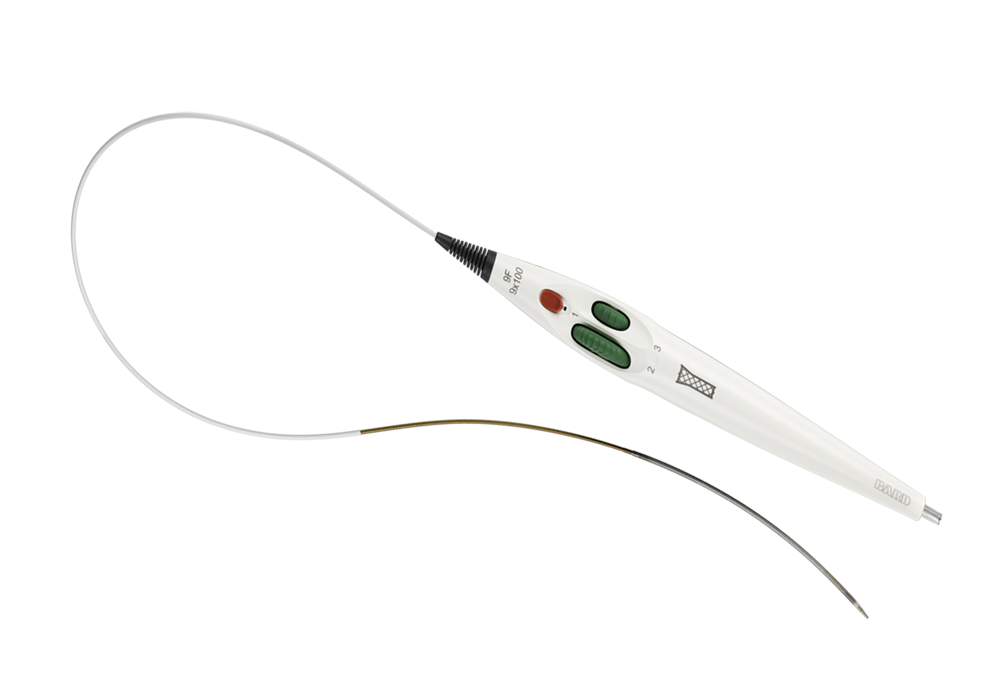
Intuicyjny trójosiowy system wprowadzający przeznaczony do precyzyjnego pozycjonowania i optymalnego zakrywania zmian
- 1
- 2
- 3
Koszulka stabilizująca zapewnia płynne i precyzyjne wprowadzanie
Pokrętła o podwójnej prędkości do kontroli zabiegu
Ergonomiczny uchwyt do obsługi jedną ręką
***W Stanach Zjednoczonych od stycznia 2023 r.
1 Dolmatch B, Waheed U, Balamuthusamy S, Hoggard J, Settlage R; AVeVA Trial Investigators. Prospective, Multicenter Clinical Study of the Covera Vascular Covered Stent in the Treatment of Stenosis at the Graft-Vein Anastomosis of Dysfunctional Hemodialysis Access Grafts. J Vasc Interv Radiol. 2022;33(5):479-488.e3. doi:10.1016/j. jvir.2022.02.008. Dane z badań klinicznych AVeNEW w archiwum. Po 6 miesiącach w badaniu AVeVA zasadnicza drożność docelowej zmiany (TLPP) wyniosła 70,3% (analiza proporcjonalna). Po 6 miesiącach w badaniu AVeNEW wartość TLPP wyniosła 78,7% dla powlekanego stentu naczyniowego Covera™ w porównaniu z 47,9% dla samej PTA, P < 0,001. 130 ze 142 (91,5%) pacjentów przydzielonych losowo do grupy, w której zastosowano stent naczyniowy Covera™, i 123 ze 138 (89,1%) pacjentów przydzielonych losowo do grupy PTA ukończyło 6-miesięczną obserwację. TLPP zdefiniowano jako odstęp od głównej interwencji do kolejnej klinicznie uzasadnionej ponownej interwencji w pierwotnym miejscu leczenia lub w jego pobliżu lub do momentu, gdy przestano korzystać z kończyny w celu uzyskiwania stałego dostępu. W AVeNEW dane TLPP z analizy w podgrupach po 6 miesiącach są dostarczane jako dane obserwacyjne bez wartości P. W badaniu AVeNEW u pacjentów, którzy otrzymali powlekany stent naczyniowy Covera™, przeprowadzono 103 ponowne interwencje w nowej zmianie, natomiast w grupie otrzymującej tylko PTA przeprowadzono 72 ponowne interwencje w ciągu 24 miesięcy. Po 30 dniach w badaniu AVeVa nie stwierdzono istotnych zdarzeń związanych z bezpieczeństwem odpowiednio w 96,4% przypadków, a w badaniu AVeNEW odsetek ten wynosił odpowiednio 95,0% (powlekany stent naczyniowy Covera™) i 96,4% (sam PTA) (p < 0,0022). Istotne zdarzenie związane z bezpieczeństwem definiowano jako zdarzenie niepożądane dotyczące obwodu dostępu, które skutkowało dodatkową interwencją, zabiegiem chirurgicznym, hospitalizacją lub zgonem.
Informacje dotyczące wskazań, przeciwwskazań, ostrzeżeń, środków ostrożności, powikłań i zdarzeń niepożądanych oraz szczegółowe informacje dotyczące bezpieczeństwa znajdują się w instrukcji użycia.
BD-23522v2
Powlekany stent naczyniowy Covera™ został zaprojektowany, aby leczyć problematyczne zmiany w obrębie obwodu dostępu AV — w tym końca łuku żyły odpromieniowej, przemieszczoną żyłę odłokciową i zespolenia żylnego graftu.
Powlekany stent naczyniowy Covera™ uzyskał dobre wyniki skuteczności w dwóch oddzielnych badaniach klinicznych, jednym u pacjentów dializowanych przy użyciu protez AV i jednym u pacjentów dializowanych z przetoką AV1
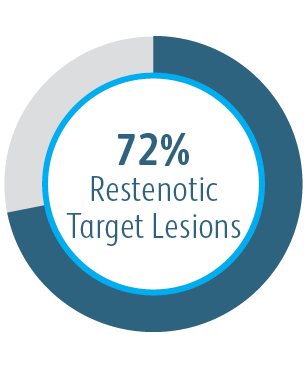
AVeVA było prospektywnym, nierandomizowanym, wieloośrodkowym badaniem prowadzonym w jednej grupie powlekanego stentu naczyniowego Covera™ stosowanego w leczeniu zwężeń w miejscu zespolenia pomostu tętniczo-żylnego i żyły odpływowej. Powlekany stent naczyniowy Covera™ zastosowano u 110 pacjentów w 14 ośrodkach badawczych w Stanach Zjednoczonych
Badanie kliniczne AVeVA wykazało, że powlekany stent naczyniowy Covera™ jest skuteczny w leczeniu zwężenia zespolenia żylnego u pacjentów dializowanych za pomocą przeszczepu AV.
| Projekt badania | Prospektywne, nierandomizowane, wieloośrodkowe, prowadzone w jednej grupie |
| Cel | Ocena bezpieczeństwa i skuteczności powlekanego stentu naczyniowego Covera™ w leczeniu zmian stenotycznych w zespoleniu przeszczep-żyła u pacjentów poddawanych hemodializie dializacyjnej z użyciem przeszczepu AV |
| Stan | Zakończona 24-miesięczna obserwacja |
| Liczba pacjentów/ośrodków | Powlekany stent naczyniowy Covera™ zastosowano u 110 pacjentów w 14 ośrodkach badawczych w Stanach Zjednoczonych |
| Główny punkt końcowy skuteczności | Zasadnicza drożność zmiany docelowej (TLPP) w 6 miesiącu |
| Główny punkt końcowy bezpieczeństwa | Brak zdarzeń niepożądanych dotyczących obwodu dostępu, skutkujących dodatkową interwencją, zabiegiem chirurgicznym, hospitalizacją lub zgonem w ciągu 30 dni |
| Obserwacja | W 30 i 90 dniu; w 6, 12, 18 i 24 miesiącu |
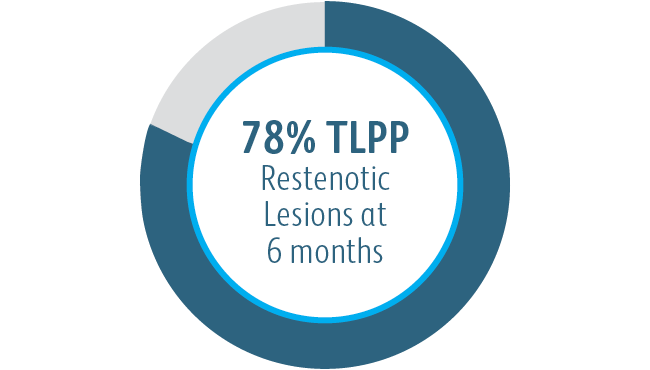
Zasadnicza drożność zmiany docelowej (TLPP) w 6 miesiącu po leczeniu stenozy zespalanych przeszczepów AV za pomocą stentgraftów BD
Poniższy wykres służy wyłącznie do celów poglądowych, a nie do celów porównawczych. Różnice w projekcie badania mogą mieć wpływ na wyniki. Aby uzyskać szczegółowe informacje dotyczące projektu badania, należy zapoznać się z kompletnymi materiałami źródłowymi.
W badaniu klinicznym AVeVA powlekany stent naczyniowy Covera™ był oceniany w grupie pacjentów stanowiących trudne przypadki.
| Projekt badania | Prospektywne, wieloośrodkowe, randomizowane, z równoległą grupą kontrolną |
| Cel | Sprawdzano bezpieczeństwo i skuteczność stosowania powlekanego stentu naczyniowego Covera™ w leczeniu zmian zwężeniowych w odpływie żylnym z dostępu AV w kończynie górnej u pacjentów hemodializowanych z zastosowaniem przetoki AV |
| Stan | Zakończona 24-miesięczna obserwacja |
| Liczba pacjentów/ośrodków | 280 randomizowanych pacjentów w 24 ośrodkach badawczych (USA, UE i ANZ) |
| Główny punkt końcowy skuteczności | Zasadnicza drożność zmiany docelowej (TLPP) w 6 miesiącu |
| Główny punkt końcowy bezpieczeństwa | Brak jakichkolwiek poważnych zdarzeń związanych z bezpieczeństwem określonych protokołem, które dotyczyłyby dostępu AV w ciągu 30 dni |
| Obserwacja | Przy wypisie ze szpitala, w dniach 30 i 90; w 6, 12, 18 i 24 miesiącu |
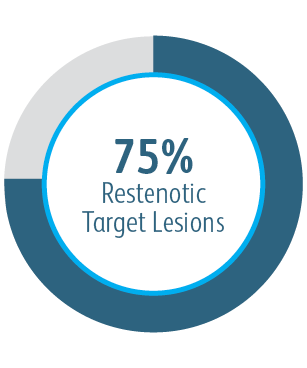
W badaniu klinicznym AVeNEW powlekany naczyniowy stent Covera™ był stosowany u pacjentów stanowiących trudne przypadki pod względem ogólnym i pod względem leczonej zmiany.
Powlekany stent naczyniowy Covera™ miał przewagę nad stanowiącą aktywny komparator PTA w 6 i 12 miesiącu w odniesieniu do TLPP w leczeniu zwężeniach odpływu żylnego u pacjentów dializowanych poprzez przetokę tętniczo-żylną.
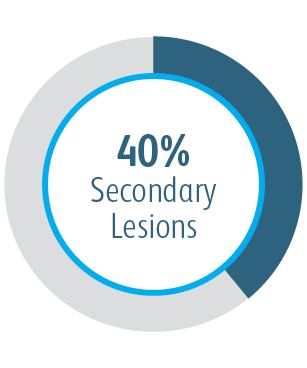
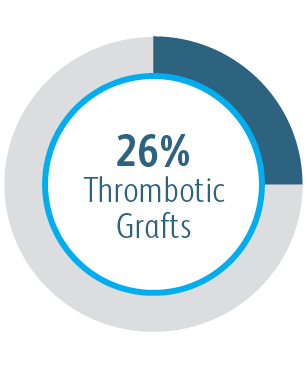
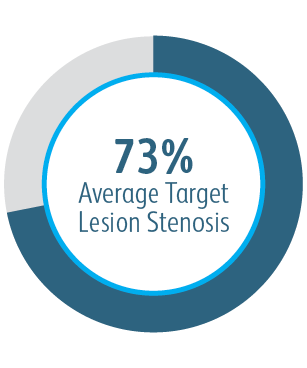
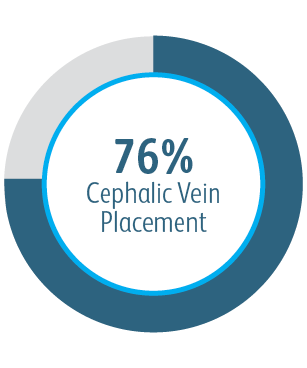
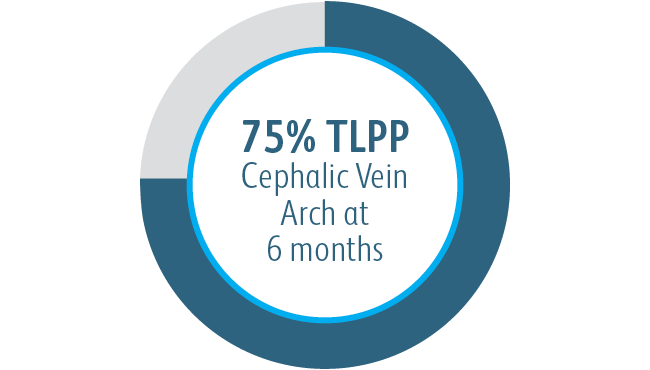
We wszystkich podgrupach wykazano korzyści po 6 miesiącach
We wszystkich analizowanych podgrupach dotyczących umiejscowienia zmiany powlekany stent naczyniowy Covera™ pozwalał uzyskać lepszą zasadniczą drożność zmiany docelowej w porównaniu ze stosowaną samodzielnie PTA, w tym w przypadku leczenia zmiany w obrębie łuku żyły odpromieniowej.
Dodatkowe punkty końcowe badania klinicznego AVeNEW
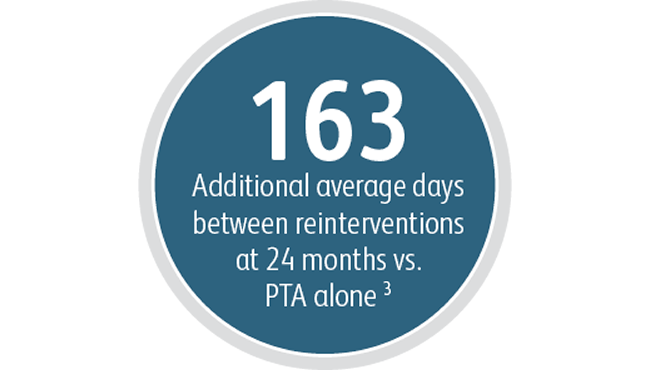
Poza korzyściami w zakresie zasadniczej drożności zmiany docelowej, powlekany stent naczyniowy Covera™ wykazał wysoki stopień bezpośredniego powodzenia technicznego i wydłużył średni czas między interwencjami w docelowej zmiany w porównaniu ze stosowanym samodzielnie zabiegiem PTA.
W badaniu klinicznym AVeNEW 77 pacjentów ze zwężeniami łuku żyły odpromieniowej leczono
powlekanym stentem naczyniowy Covera™.
W tym przypadku angiografia wskazywała na zwężenie naczynia w punkcie początkowym oraz bezpośrednie powodzenie techniczne rozszerzenia naczynia i dostosowanie się do kształtu powlekanego stentu.
* Haskal ZJ, Trerotola S, Dolmatch B, et al. Stent graft versus balloon angioplasty for failing dialysis-access grafts. N Engl J Med. 2010 Feb 11;362(6):494-503.
** Haskal ZJ, Saad TF, Hoggard JG, et al. Prospective, randomized, concurrently-controlled study of a stent graft versus balloon angioplasty for treatment of arteriovenous access graft stenosis: 2-year results of the RENOVA study. J Vasc Interv Radiol. 2016 Aug;27(8):1105-1114.e3.
***In U.S. as of Nov. 2022
1 Dolmatch B, Waheed U, Balamuthusamy S, Hoggard J, Settlage R; AVeVA Trial Investigators. Prospective, multicenter clinical study of the Covera Vascular Covered Stent in the treatment of stenosis at the graft-vein anastomosis of dysfunctional hemodialysis access grafts. J Vasc Interv Radiol. 2022;33(5):479-488.e3. doi:10.1016/j. jvir.2022.02.008. Dane z badań klinicznych AVeNEW w archiwum. Po 6 miesiącach w badaniu AVeVA, zasadnicza drożność zmiany docelowej (TLPP) wyniosła 70,3% (analiza proporcjonalna). Po 6 miesiącach w badaniu AVeNEW wartość TLPP wyniosła 78,7% dla powlekanego stentu naczyniowego Covera™ w porównaniu z 47,9% dla samej PTA, P < 0,001. 130 ze 142 (91,5%) pacjentów przydzielonych losowo do grupy, w której zastosowano stent naczyniowy Covera™, i 123 ze 138 (89,1%) pacjentów przydzielonych losowo do grupy PTA ukończyło 6-miesięczną obserwację. TLPP zdefiniowano jako odstęp od głównej interwencji do kolejnej klinicznie uzasadnionej ponownej interwencji w pierwotnym miejscu leczenia lub w jego pobliżu lub do momentu, gdy przestano korzystać z kończyny w celu uzyskiwania stałego dostępu. W AVeNEW dane TLPP z analizy w podgrupach po 6 miesiącach są dostarczane jako dane obserwacyjne bez wartości P. W badaniu AVeNEW u pacjentów, którzy otrzymali powlekany stent naczyniowy Covera™, przeprowadzono 103 ponowne interwencje w nowej zmianie, natomiast w grupie otrzymującej tylko PTA przeprowadzono 72 ponowne interwencje w ciągu 24 miesięcy. Po 30 dniach w badaniu AVeVa nie stwierdzono istotnych zdarzeń związanych z bezpieczeństwem odpowiednio w 96,4% przypadków, a w badaniu AVeNEW odsetek ten wynosił odpowiednio 95,0% (powlekany stent naczyniowy Covera™) i 96,4% (sam PTA) (p < 0,0022). Istotne zdarzenie związane z bezpieczeństwem definiowano jako zdarzenie niepożądane dotyczące obrębu dostępu, które skutkowało dodatkową interwencją, zabiegiem chirurgicznym, hospitalizacją lub zgonem.
2 Bezpośredni sukces techniczny zdefiniowano jako pomyślne rozprężenie implantu w zamierzonej lokalizacji na podstawie oceny operatora dokonanej podczas głównej procedury. Badanie kliniczne AVeNEW. Dane zarchiwizowane. Bard Peripheral Vascular Inc., Tempe, AZ.
3 Wskaźnik funkcji drożności zmiany docelowej (IPF-T) jest definiowany jako czas od głównej procedury badania do zakończenia badania lub do momentu, gdy przestano korzystać z miejsca dostępu, podzielony przez liczbę wizyt z ponowną interwencją w obrębie docelowej zmiany w celu utrzymania dostępu naczyniowego do hemodializy. Średnia wartość IPF-T wynosiła 380,40 dnia z powlekanym stentem naczyniowym Covera™ i 217,57 dnia dla samego PTA w 24 miesiącu. Badanie kliniczne AVeNEW. Dane zarchiwizowane. Bard Peripheral Vascular Inc., Tempe, AZ.
Informacje dotyczące wskazań, przeciwwskazań, ostrzeżeń, środków ostrożności, powikłań i zdarzeń niepożądanych oraz szczegółowe informacje dotyczące bezpieczeństwa znajdują się w instrukcji użycia.
BD-23522v2