Badanie kliniczne Arista™ AH PMA P050038.
Szczegółowe opisy stosowania znajdują się w pełnej Instrukcji użycia.
Instrukcja użycia Arista™ AH.
Zastrzeżenia
Nie wszystkie produkty, usługi, oświadczenia lub funkcje produktów mogą być dostępne lub ważne w regionie użytkownika. Należy skontaktować się z lokalnym przedstawicielem firmy BD.
Wszelkie wskazania, przeciwwskazania, zagrożenia, ostrzeżenia, środki ostrożności znajdują się na etykietach i w instrukcjach użycia.
Wskazania
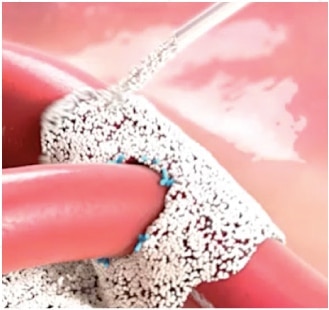
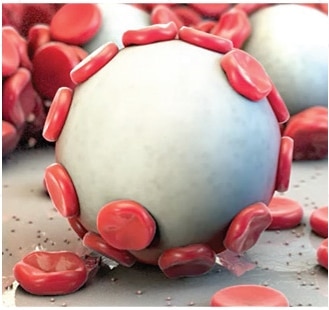
Arista™ AH stosowany jest pomocniczo w zabiegach chirurgicznych (z wyjątkiem procedur okulistycznych) jako dodatkowy materiał hemostatyczny w przypadkach, gdy hamowanie krwawienia kapilarnego, żylnego i tętniczego przy użyciu nacisku, ligatury i innych konwencjonalnych procedur, okazuje się nieskuteczne lub niepraktyczne.
Przeciwwskazania
Nie wstrzykiwać ani nie wprowadzać leku Arista™ AH do naczyń krwionośnych, ponieważ istnieje ryzyko embolizacji i zgonu.
Ostrzeżenia
Bezpieczeństwo i skuteczność preparatu Arista™ AH nie zostało zbadane klinicznie u dzieci, kobiet w ciąży i/lub karmiących piersią. Ze względu na doniesienia o zmniejszonej aktywności amylazy u noworodków do 10 miesięcy, współczynnik absorpcji Arista™ AH w tej populacji może przekraczać 48 godzin.
Po osiągnięciu hemostazy nadmiar preparatu Arista™ AH należy usunąć z miejsca zastosowania poprzez irygację i aspirację, szczególnie w przypadku zastosowania wokół otworów kostnych, obszarów ograniczonych tkanką kostną, rdzenia kręgowego i/lub nerwu oraz skrzyżowania wzrokowego. Arista™ AH pęcznieje do maksymalnej objętości natychmiast po kontakcie z krwią lub innymi płynami. Zaschnięty, biały preparat Arista™ AH należy usunąć. Możliwość zakłócenia przez produkt normalnego funkcjonowania i/lub spowodowania martwicy kompresyjnej otaczających tkanek z powodu obrzęku, jest zmniejszona poprzez usunięcie nadmiaru suchego materiału.
Niniejszy produkt jest przeznaczony wyłącznie do jednorazowego użytku. Ponowne użycie, przygotowanie do ponownego użycia, ponowna sterylizacja lub przepakowanie może naruszyć integralność konstrukcyjną i/lub podstawowe właściwości materiału i konstrukcji, które mają kluczowe znaczenie dla ogólnego działania siatki i mogą prowadzić do jej uszkodzenia, co może spowodować obrażenia pacjenta. Ponowne użycie, przetwarzanie, wyjaławianie lub przepakowanie może również stwarzać ryzyko zanieczyszczenia produktu i/lub doprowadzić do zakażenia pacjenta lub przeniesienia zakażenia, w tym w szczególności przeniesienia choroby zakaźnej z jednego pacjenta na drugiego. Zanieczyszczenie produktu może doprowadzić do urazu, choroby lub zgonu pacjenta bądź użytkownika.
Arista™ AH nie jest przeznaczony do zastępowania drobiazgowych technik chirurgicznych oraz właściwego zastosowania ligatur lub innych konwencjonalnych zabiegów w celu hemostazy.
Bezpieczeństwo i skuteczność zabiegów okulistycznych nie zostały ustalone.
Arista™ AH nie powinien być stosowany do hamowania krwawienia po porodzie lub krwotoku miesiączkowego.
Arista™ AH należy stosować ostrożnie w obecności zakażenia lub w przypadku zanieczyszczonych obszarów ciała. Jeżeli w miejscu zastosowania preparatu Arista™ AH pojawi się zakażenie lub ropień, może być konieczna ponowna operacja w celu drenażu.
Produkt po użyciu należy wyrzucić. Produkt może stanowić potencjalne zagrożenie biologiczne. Należy z niego korzystać i utylizować go zgodnie z przyjętą praktyką medyczną oraz obowiązującymi przepisami lokalnymi i krajowymi.
Środki ostrożności
Produkt powinien być używany wyłącznie przez lekarzy posiadających kwalifikacje w zakresie odpowiednich technik chirurgicznych.
Bezpieczeństwo i skuteczność stosowania w procedurach neurologicznych nie zostały ustalone w drodze randomizowanych badań klinicznych.
Gdy produkt Arista™ AH jest stosowany w połączeniu z autologicznymi układami odzyskiwania krwi, należy dokładnie przestrzegać instrukcji zawartych w sekcji Podawanie, dotyczących właściwej filtracji i płukania komórek.
Arista™ AH jest przeznaczony do stosowania w stanie suchym. Kontakt z roztworem soli fizjologicznej lub roztworem antybiotyku przed uzyskaniem hemostazy spowoduje utratę potencjału hemostatycznego.
Arista™ AH jest dostarczany jako produkt jałowy i nie można go ponownie sterylizować. Niezużyte, otwarte pojemniki Arista™ AH należy wyrzucić.
Nie stosować więcej niż 50 g produktu Arista™ AH u pacjentów z cukrzycą, ponieważ obliczono, że ilość przekraczająca tę wartość może wpłynąć na obciążenie glukozą.
Arista™ AH nie jest zalecany jako podstawowa metoda leczenia zaburzeń krzepnięcia.
W trakcie zabiegów urologicznych Arista™ AH nie może dostać się do miedniczki nerkowej lub moczowodów, aby wyeliminować potencjalne ogniska tworzenia się kamienia moczowego.
Nie przeprowadzono żadnych badań produktu Arista™ AH na powierzchni kości, do której materiały protetyczne mają być przymocowane za pomocą cementów, w związku z tym nie jest to zalecane.
Działania niepożądane
W randomizowanym, prospektywnym badaniu klinicznym z grupą kontrolną otrzymującą jednoczesne leczenie, łącznie u 288 randomizowanych pacjentów zastosowano produkt Arista™ AH lub produkt kontrolny (gąbkę żelatynową z trombiną lub bez). Najczęściej rejestrowanymi zdarzeniami niepożądanymi były: ból związany z zabiegiem chirurgicznym, niedokrwistość, nudności i nieprawidłowe wyniki laboratoryjne. Poniżej znajduje się pełna lista zdarzeń niepożądanych zgłoszonych u ponad 5% pacjentów leczonych z udziałem produktu Arista™ AH. Dla porównania wymieniono odpowiednie zdarzenia niepożądane w grupie kontrolnej. Komisja ds. monitorowania bezpieczeństwa danych uznała, że żadne z występujących zdarzeń niepożądanych, nie jest związane ze stosowaniem Arista™ AH. Wszelkie wskazania, przeciwwskazania, zagrożenia, ostrzeżenia, środki ostrożności oraz instrukcje użycia znajdują się na etykietach i ulotkach informacyjnych produktów.
BD-51218 (08/22)