Veuillez noter que certains produits, services ou caractéristiques peuvent ne pas être disponibles dans votre région. Veuillez consulter votre représentant BD local.
Indications
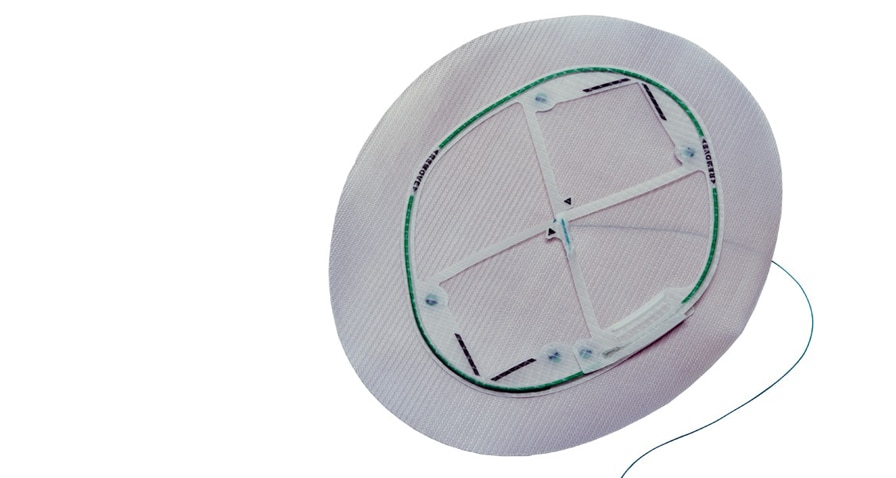
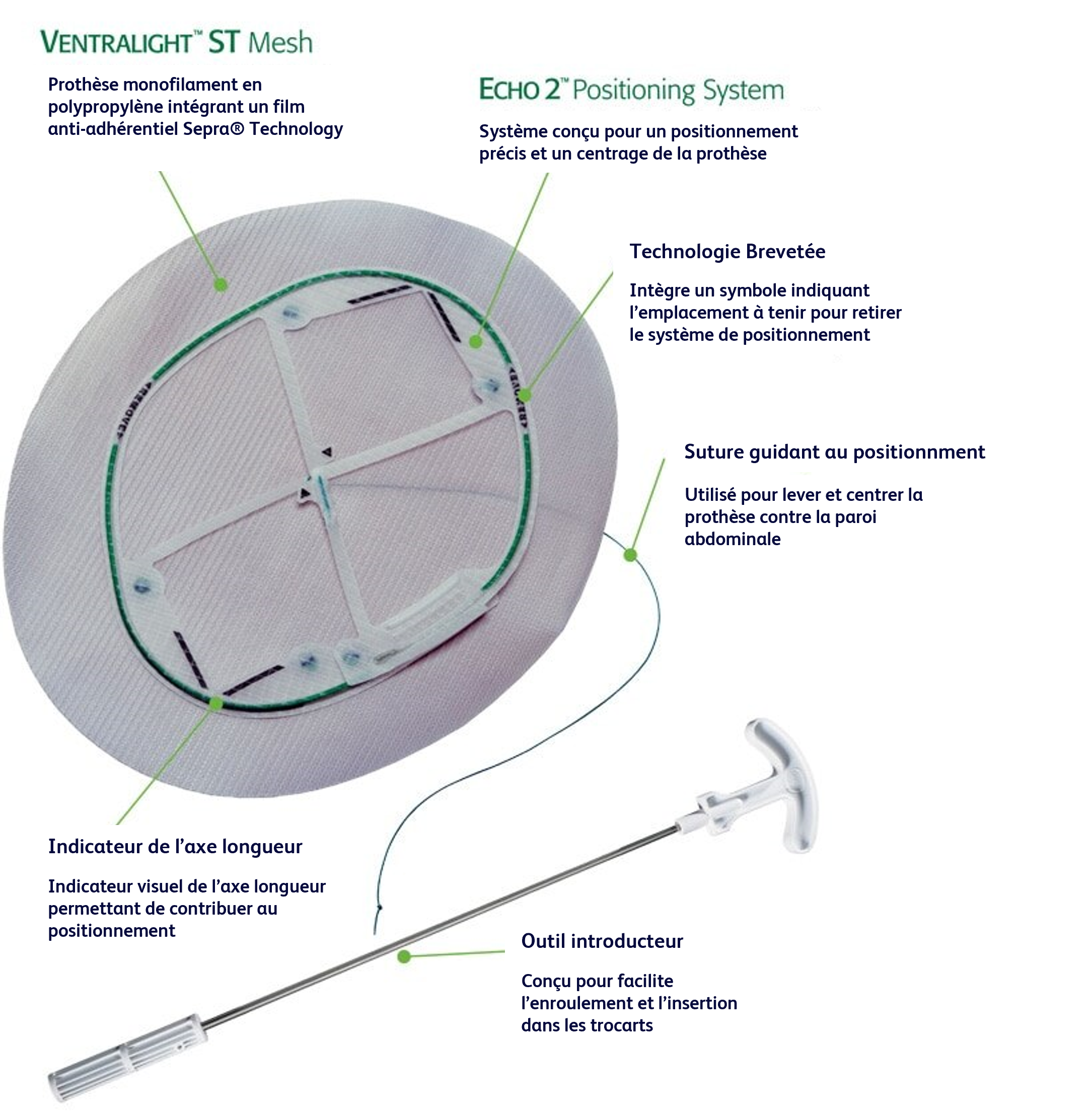
La maille Ventralight™ ST est indiquée pour la reconstruction d’anomalies des tissus mous, comme dans la réparation d’une hernie ventrale, incisionnelle et ombilicale. Le système de positionnement Echo 2™ est conçu pour faciliter la mise en place et le positionnement de la maille Ventralight™ ST dans le cadre d’une réparation de hernie par laparoscopie.
Contre-indications
1. N’utilisez pas la maille chez les nourrissons, les enfants ou les femmes enceintes ; leur croissance pourrait être compromise par l’utilisation de ce type de matériau de maille.
2. L’utilisation de cette maille chez les femmes enceintes ou qui allaitent n’a pas été évaluée.
3. N’utilisez pas cette maille pour la reconstruction d’anomalies cardiovasculaires.
4. Selon la littérature, des adhérences peuvent se former si le polypropylène est placé en contact avec l’intestin ou les viscères.
Avertissements
1. L’utilisation d’un patch ou d’une maille permanent sur une blessure contaminée ou infectée peut entraîner la formation de fistules et/ou l’extrusion de la maille.
2. En cas d’infection, un traitement agressif s’impose. Le retrait de la maille doit également être envisagé. Une infection non traitée peut nécessiter le retrait de la maille.
3. Si la maille inutilisée est entrée en contact avec des instruments ou des consommables utilisés sur un patient ou si elle a été contaminée par des fluides organiques, éliminez-la soigneusement afin d’éviter tout risque de transmission d’infections virales ou autres.
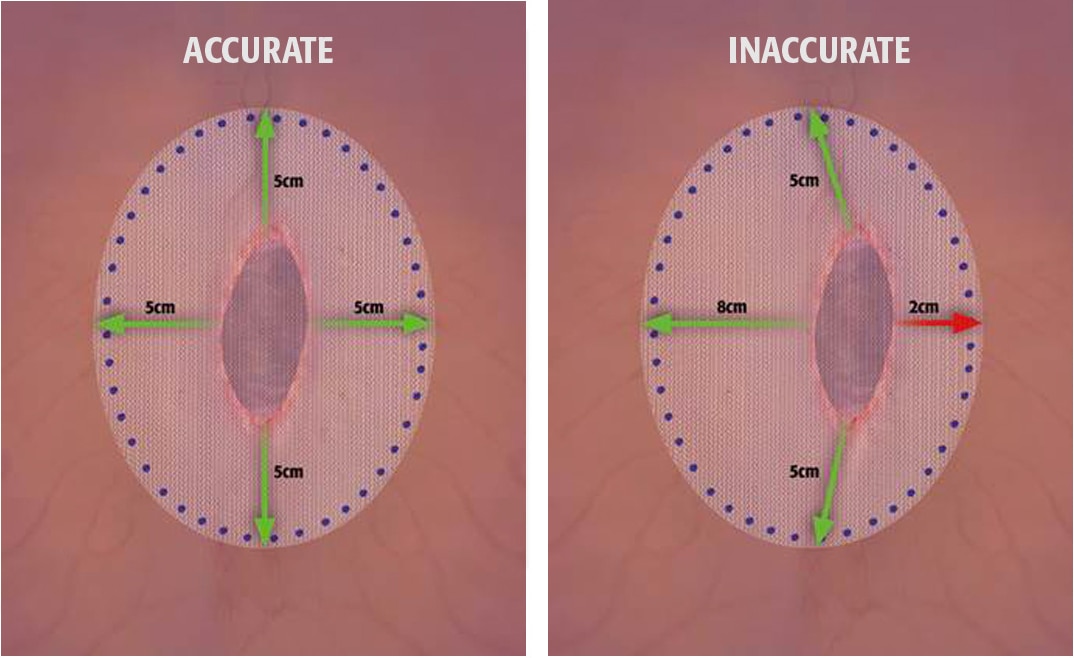
4. Pour prévenir toute récidive lors de la réparation d’une hernie, la maille doit être suffisamment grande pour dépasser des bords de la zone de l’anomalie, en tenant compte de tout facteur clinique supplémentaire propre au patient. Il convient de porter une grande attention au positionnement et à l’espacement de la fixation de la maille afin d’éviter toute tension excessive ou formation d’un espace entre la maille et le tissu fascial.
5. Ce dispositif est fourni stérile. Inspectez l’emballage pour vérifier qu’il est intact et non endommagé avant utilisation.
6. Ce dispositif est à usage unique. La réutilisation, le retraitement, la restérilisation et/ou le reconditionnement pourraient compromettre l’intégrité structurelle et/ou les principales caractéristiques conceptuelles ou matérielles, essentielles aux performances générales du dispositif, et entraîner un dysfonctionnement de ce dernier, causant potentiellement des blessures au patient. La réutilisation, le retraitement, la restérilisation ou le reconditionnement pourraient également générer un risque de contamination du dispositif et/ou entraîner une infection ou une infection croisée chez le patient, notamment la transmission de maladies infectieuses d’un patient à un autre. La contamination du dispositif peut entraîner des lésions, des maladies ou le décès du patient ou de l’utilisateur final.
7. Cette maille doit être utilisée dès que le sachet extérieur en aluminium a été ouvert. Ne le conservez pas en vue d’une utilisation ultérieure. Éliminez les parties inutilisées de la maille.
8. Veillez à son orientation correcte ; le côté enduit de la maille doit être orienté contre l’intestin ou les organes sensibles. Ne placez pas le côté polypropylène contre l’intestin. Des adhérences pourraient se former si le côté polypropylène est placé en contact direct avec l’intestin ou les viscères (voir « Orientation de surface »).
9. N’appliquez pas d’outils de cautérisation, tranchants, pointus ou émettant des ultrasons (tels que des ciseaux, des aiguilles, des agrafes, des outils diathermiques, etc.) sur le cadre du système de positionnement Echo 2™.
10. Ce dispositif comprend un fil en nitinol hyper élastique ; évitez de couper et de mettre en contact/fixer directement le dispositif avec des électrodes chirurgicales actives.
11. La maille Ventralight™ ST est le seul implant permanent du dispositif. Le système de positionnement Echo 2™ (comprenant le cadre de déploiement, la suture d’ancrage centrale et tous les connecteurs) doit être retiré du patient et éliminé de manière adéquate. Il ne fait pas partie de l’implant permanent.
12. Le système de positionnement Echo 2™ ne doit pas être utilisé avec d’autres prothèses de hernie que celles avec lesquelles il est livré/auxquelles il est préfixé.
13. Éliminez le système de positionnement Echo 2™ (y compris le cadre, la suture d’ancrage centrale, tous les connecteurs et l’introduction de la maille) après utilisation. Il peut présenter un risque biologique. La manipulation et l’élimination doivent s’effectuer conformément aux pratiques médicales acceptées et aux réglementations locales et nationales en vigueur.
14. Cette maille n’est pas conçue pour la réparation du prolapsus des organes pelviens par voie transvaginale.
15. Cette maille n’est pas conçue pour le traitement de l’incontinence urinaire à l’effort.
Précautions
1. Lisez l’intégralité des instructions avant utilisation.
2. Seuls les médecins dûment formés et qualifiés aux techniques chirurgicales appropriées doivent utiliser ce dispositif.
3. La sécurité et l’efficacité du dispositif en présence de tumeurs malignes dans la cavité abdomino-pelvienne n’ont pas été évaluées.
4. La visualisation doit être préservée tout au long de l’intervention chirurgicale. En outre, le retrait du système de positionnement Echo 2™ sous laparoscopie nécessite une visualisation suffisante de l’ensemble du dispositif et de l’anatomie voisine pour permettre son retrait adéquat.
5. Ne coupez pas la maille. Cela affecterait l’interface entre la maille et le système de positionnement.
Réactions indésirables
Les complications possibles peuvent notamment inclure sérome, adhérence, hématome, douleur, infection, inflammation, extrusion, érosion, migration, formation de fistules, réaction allergique et récidive de la hernie ou de l’anomalie des tissus mous.
Veuillez consulter la notice de l’emballage pour en savoir plus sur les informations de sécurité et le mode d’emploi.
Références
- LeBlanc K. “Proper mesh overlap is a key determinant in hernia recurrence following laparoscopic ventral and incisional hernia repair“ Hernia 2016 Feb;20(1):85-99.
- Liang MK, Clapp ML, Garcia A, Subramanian A, Awad SS. “Mesh shift following laparoscopic ventral hernia repair.” J Surg Res. 2012 Sep;177(1):e7-13.
- Tollens T, Topal H, Ovaere S, Beunis A, Vermeiren K, Aelvoet C. “Prospective analysis of ventral hernia repair using the Ventralight™ ST hernia patch.” Surg Technol Int. 2013 Sep;23:113-6.
- Références disponibles sur demande.