For more information, please contact your local sales rep to learn more
2. Internal market research, data on file, 2015.
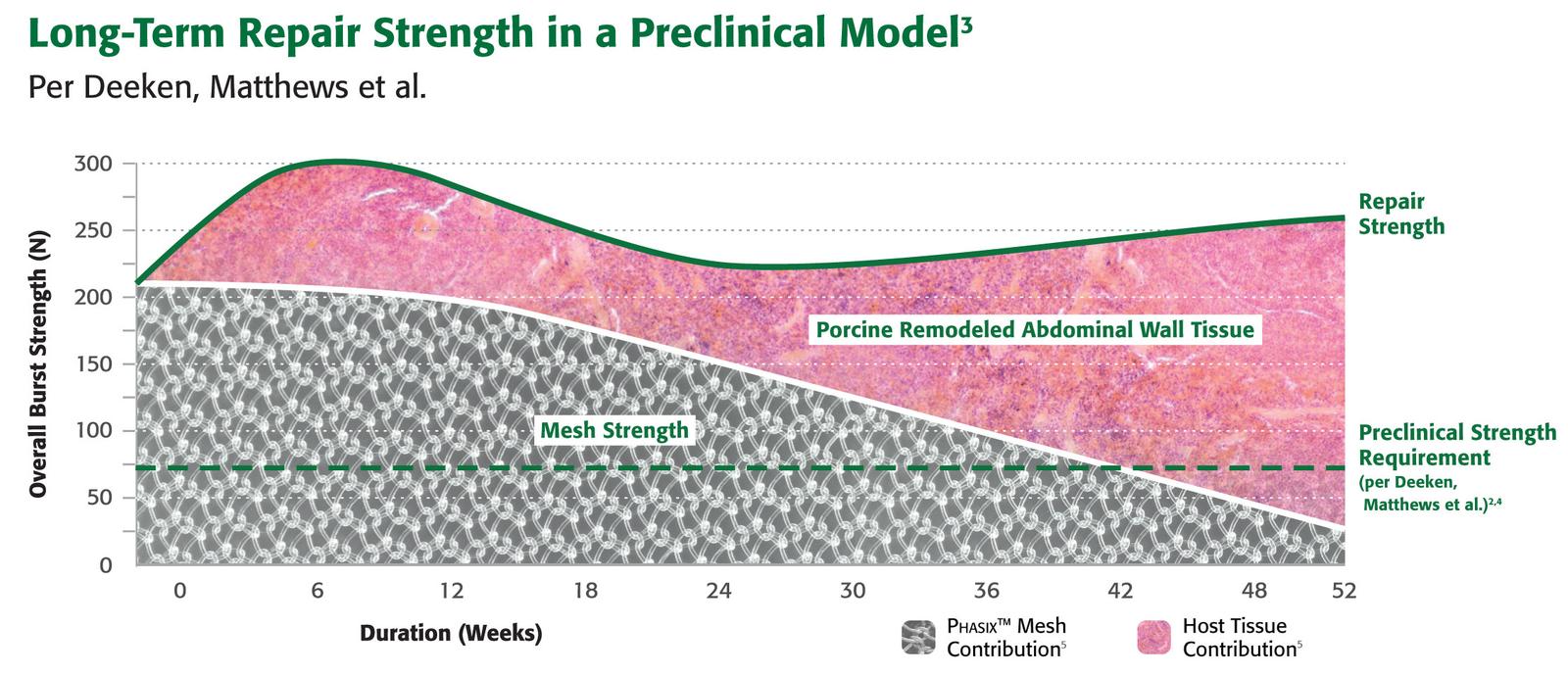
3. Liang MK, Li LT, Nguyen MT, Berger RL, Hicks SC, Kao LS. Abdominal reoperation and mesh explantation following open ventral hernia repair with mesh. The American Journal of Surgery. 208.4(2014):670–76.
4. Itani KM, et al. Prospective study of single-stage repair of contaminated hernias using a biologic porcine tissue matrix: the RICH Study. Surgery. 2012;152(3):498–505.
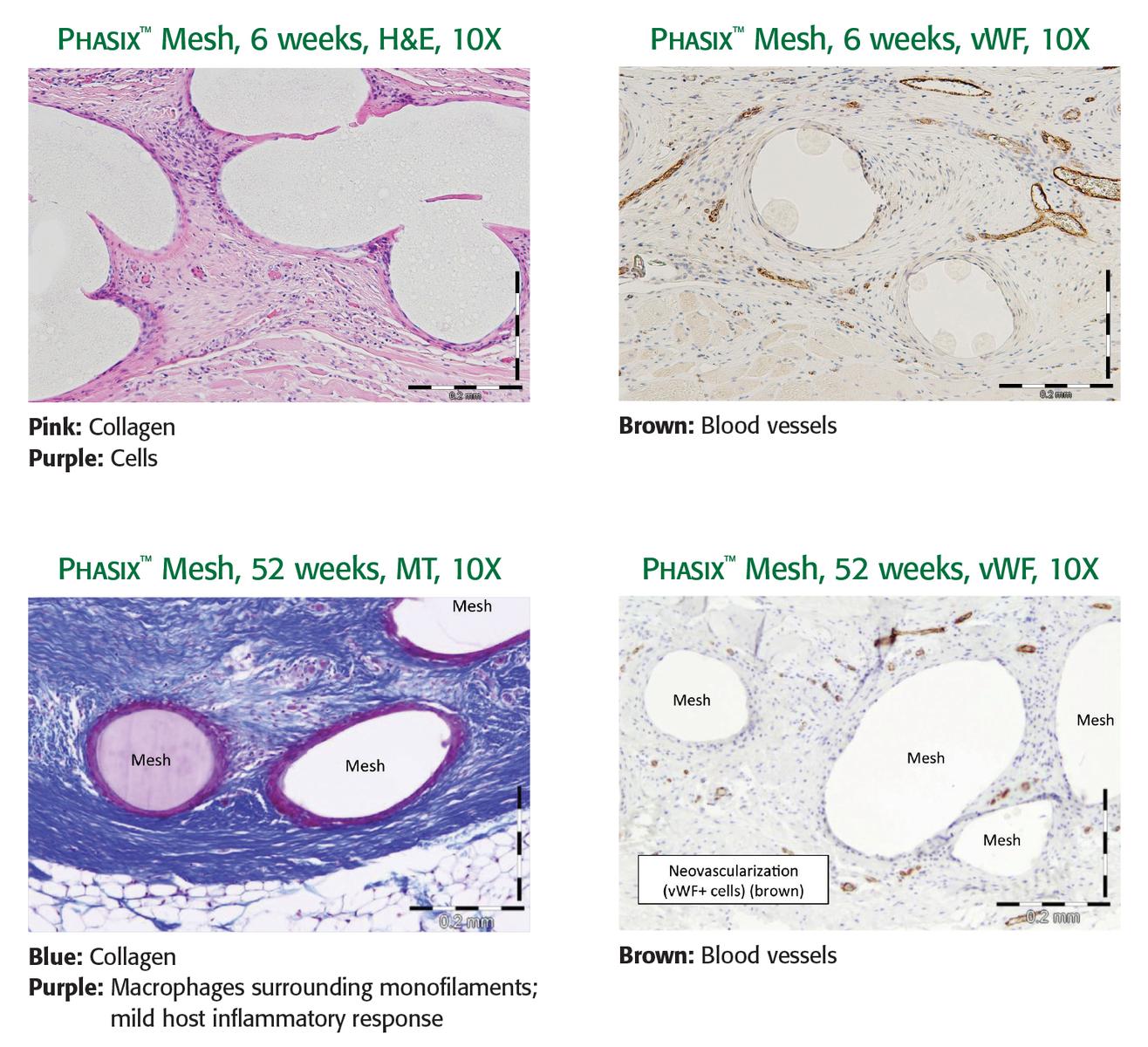
5. Annor AH, Tang ME, Pui CL, Ebersole GC, Frisella MM, Matthews BD, Deeken CR. Effect of enzymatic degradation on the mechanical properties of biological scaffold materials. Surgical Endoscopy. 26.10(2012):2767–778. 6. Harth KC, et al. Effect of surgical wound classification on biologic graft performance in complex hernia repair: an experimental study. Surgery. 2013;153(4):481–492
BD-46830