Progel Platinum™ chirurgischer Versiegler
Die beispiellose Option bei postoperativen Komplikationen durch Luftaustritt

- Übersicht
- EIFU & weitere Informationen
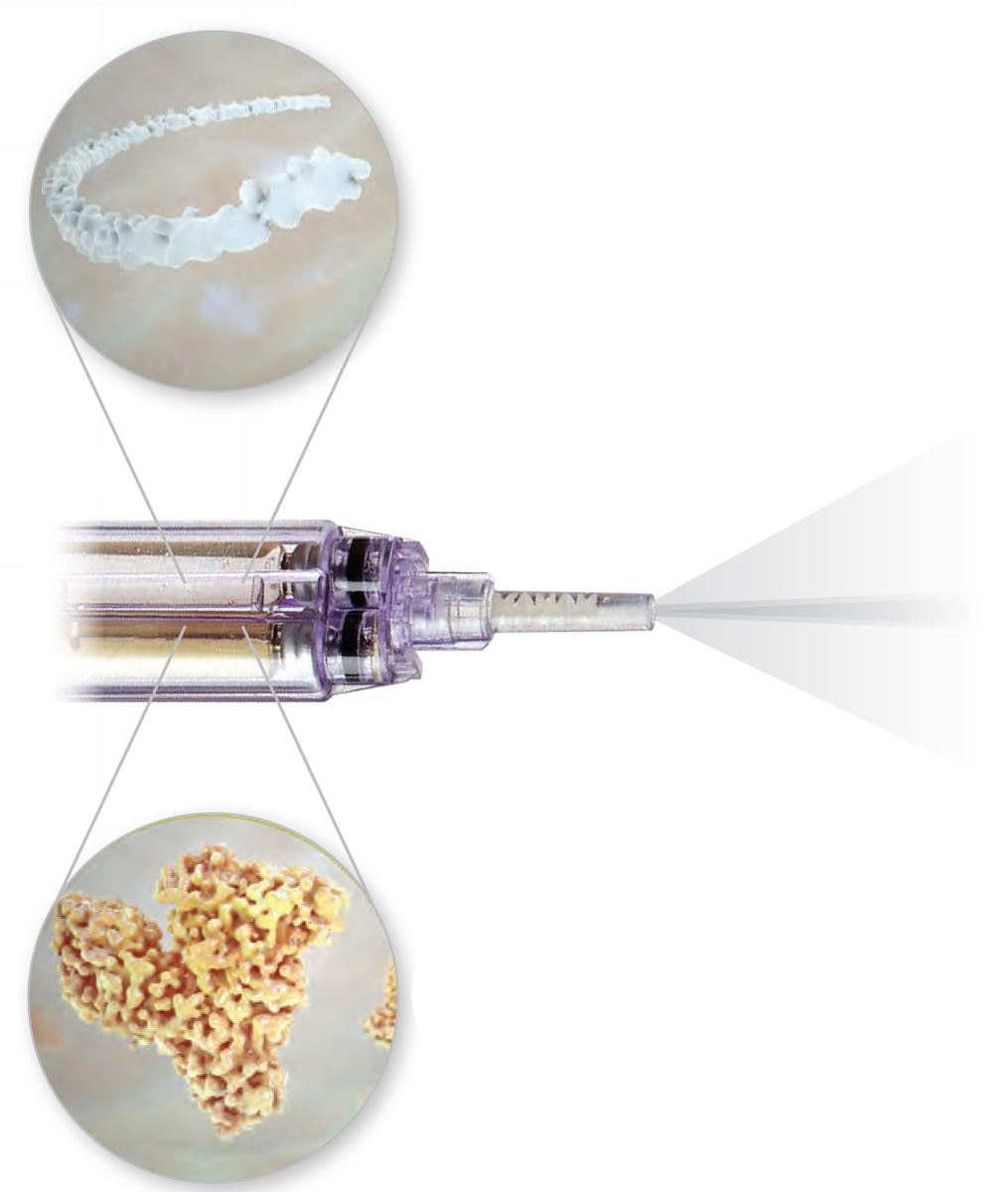
Ausgelegt auf
PEG: Stärke und Flexibilität
Das in der Progel Platinum™-Formulierung verwendete proprietäre Polyethylenglykol (PEG) ist ein ungiftiges, nicht immunogenes Molekül9, das dem Hydrogel seine Dehnbarkeit verleiht.
rHA: optimaler Kontakt und Adhärenz
Rekombinantes Humanalbumin (rHA) ist ein großes Proteinmolekül, das Progel Platinum™ seine Haftkraft verleiht.
Ausgelegt auf
- Der einzige Versiegler, der speziell für die Anwendung in der Lunge und ihren speziellen Eigenschaften entwickelt wurde
- Kombiniert Polyethylenglykol (PEG) und rekombinantes humanes Albumin (rHA) zu einem flexiblen Hydrogel
- Geliert an der Gewebestelle und verbindet sich direkt mit der Lunge für eine optimale Haftung und eine luftdichte Versiegelung
- Stark genug, um der erneuten Ausdehnung der Lunge innerhalb von zwei Minuten nach der Anwendung standzuhalten1
- Hochelastisch, damit sich die Lunge beim Atmen natürlich ausdehnen und zusammenziehen kann
- Der patentierte Progel Platinum™ Erweiterungs-Sprühaufsatz ermöglicht die individuelle Anwendung durch ein einfach zu bedienendes Einwegprodukt
Indiziert
- Der Progel Platinum™ Versiegler ist der einzige Versiegler, der in Europa speziell für die Abdichtung von Pleuralecks zugelassen ist.
- Progel Platinum™ bildet ein hochflexibles Hydrogel, das speziell für die Anwendung an der Lunge entwickelt wurde.
- Der Progel Platinum™ Pleura chirurgische Versiegler ist das einzige von der FDA zugelassene Produkt zur Behandlung von Luftlecks, unabhängig vom Ansatz.2
Klinisch bewährt
- Der einzige Versiegler, bei dem klinisch nachgewiesen wurde, dass es Komplikationen durch Luftlecks sowohl in der offenen als auch in der minimalinvasiven Thoraxchirurgie wirksam behandeln kann1
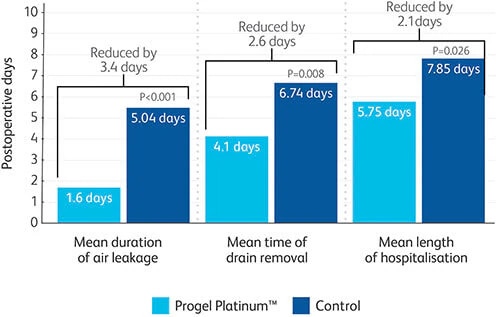
- In einer prospektiven, randomisierten, multizentrischen Studie wurde klinisch bewiesen, dass das Produkt Lecks abdichtet und die Länge des Krankenhausaufenthalts um 2,1 Tage verkürzt.3
Kostengünstig
- Bei rund 58% der Patienten in der Lungenchirurgie entsteht im OP ein Luftleck3
- Luftaustritte sind einer der wichtigsten Faktoren für die Länge des Krankenhausaufenthalts. Ein Luftaustritt über einen längeren Zeitraum kann den Krankenhausaufenthalt um mehr als vier Tage verlängern.5
- Die Gesamtkosten für die Behandlung länger andauernder postoperativer Luftlecks und der damit verbundenen klinischen Komplikationen sind erheblich.6
- Die postoperativen 90-Tage-Gesamtkosten für ein länger bestehendes Luftleck werden auf zusätzlich 5.000 € pro Patient geschätzt.7
- Der Progel Platinum™ Versiegler dichtet Luftlecks bei Lungenoperationen nachweislich wirksam ab und verkürzt die Dauer des Krankenhausaufenthalts um durchschnittlich 2,1 Tage, was zu einer Minimierung der damit verbundenen Komplikationen und zu Einsparungen bei den Behandlungskosten führen kann.8
This is a modal window.
Beginning of dialog window. Escape will cancel and close the window.
End of dialog window.
This is a modal window. This modal can be closed by pressing the Escape key or activating the close button.
Progel Platinum™ MOA animation
This is a modal window.
Beginning of dialog window. Escape will cancel and close the window.
End of dialog window.
This is a modal window. This modal can be closed by pressing the Escape key or activating the close button.
Progel Platinum™ Surgical Sealant
Hier finden Sie eine hilfreiche Sammlung weiterer Informationsmaterialien zu Ihrer Verfügung.
BD ist Gastgeber und Teilnehmer von Veranstaltungen, die Forschritt für die Welt der Gesundheit™ bringen.
Bitte beachten Sie, dass möglicherweise nicht alle Produkte, Dienstleistungen oder Merkmale von Produkten und Dienstleistungen in Ihrer Region verfügbar sind. Bitte erkundigen Sie sich bei Ihrem BD Außendienstmitarbeiter vor Ort.
Referenzen
- Progel Platinum™ Versiegler Gebrauchsanleitung. M-00351. Daten im Archiv.
- Progel Platinum™ Pleura chirurgischer Versiegler ist nicht in der EU erhältlich; der einzige Unterschied zu Progel Platinum™ chirurgischer Versiegeler besteht darin, dass letzterer aus einer geschützten Kombination von rekombinantem Humanalbumin (rHA), während PALS als Hauptkomponente aus humanem Serumalbumin (HSA) besteht.
- Allen, Mark S. et al, “Prospective Randomized Study Evaluating a Biodegradable Polymeric Sealant for Sealing Intraoperative Air Leaks That Occur During Pulmonary Resection” Annals of Thoracic Surgery 2004; 77:1792-1801. Zulassungsstudie. Daten im Archiv.
- Brunelli et al. Prädiktoren für ein längeres Luftleck nach einer Lungenlobektomie. Ann Thorac Surg 2004; 77: 1205-1210. Basierend auf der berichteten Inzidenz eines verlängerten postoperativen Luftlecks. Daten im Archiv.
- Mueller MR, Marzluf BA. Antizipation und Management von Luftlecks und Resträumen nach einer Lungenresektion. J Thorac Dis. 2014 Mar;6(3):271-84. Daten im Archiv.
- Varela G. et al. Abschätzung der Krankenhauskosten, die auf ein längeres Luftleck bei der Lungenlobektomie zurückzuführen sind. Eur J Cardiothorac Surg. 2005 Feb;27(2):329-33.
- Brunelli A et al. 90-tägige Krankenhauskosten im Zusammenhang mit längerem Luftleck nach Lungenresektion. Interact Cardiovasc Thorac Surg. 2020 Oct 1;31(4):507-512.
- Zaraca F. et al. Kostenwirksamkeitsanalyse der Dichtstoffwirkung bei der Behandlung von moderaten intraoperativen alveolaren Luftleckagen während der videoassistierten thorakoskopischen Chirurgie: eine multizentrische randomisierte kontrollierte Studie. J Thorac Dis. 2017 Dec;9(12):5230-5238)
Indikationen
Progel Platinum™ Surgical Sealant ist ein Einmalprodukt zur Anwendung bei sichtbaren Luftlecks in der viszeralen Pleura, nachdem bei der Resektion des Lungenparenchyms Standardverfahren zum Verschluss der viszeralen Pleura angewendet wurden.
Kontraindikationen
- Progel Platinum™ darf nicht bei Patienten angewendet werden, die in der Vergangenheit allergisch auf Reis, rHA oder andere Komponenten des Geräts reagiert haben.
- Progel Platinum™ nicht bei Patienten anwenden, deren Nierenkapazität für die Clearance der Polyethylenglykol-Füllung von Progel Platinum™ unzureichend sein könnte.
- Progel Platinum™ darf nicht auf offene oder geschlossene Defekte der Hauptstamm- oder Lappenbronchien aufgetragen werden, da dies die Inzidenz von bronchopleuralen Fisteln erhöhen kann, einschließlich Patienten, die sich einer Pneumonektomie, einer Sleeve-Resektion oder einer Bronchoplastik unterziehen.
- Progel Platinum™ darf nicht auf oxidierter regenerierter Zellulose, absorbierbaren Gelatineschwämmen oder anderen Oberflächen als der viszeralen Pleura angewendet werden, da die Haftung und das beabsichtigte Ergebnis beeinträchtigt werden können.
Warnhinweise
- Progel Platinum™ sollte nur wie in dieser Gebrauchsanweisung beschrieben verwendet werden.
- Progel Platinum™ sollte stets zwischen 2°C und 8°C (36°F bis 46°F) gelagert werden. Nicht einfrieren. Wird Progel Platinum™ nicht innerhalb des empfohlenen Temperaturbereichs gelagert, kann dies zu einer schlechten Produktleistung führen.
- Überprüfen Sie die Verpackungen vor dem Öffnen. Verwenden Sie Progel Platinum™ nicht nach Ablauf des Verfallsdatums, da die Sterilität oder Leistung beeinträchtigt sein kann. Wenn die Unversehrtheit der Verpackung und/oder des Produkts beeinträchtigt ist (z. B. beschädigtes Verpackungssiegel oder zerbrochenes Glas), darf der Inhalt nicht verwendet oder resterilisiert werden.
- Dieses Produkt ist nur für den einmaligen Gebrauch verpackt und sterilisiert.
- Nicht wiederverwenden oder wiederaufbereiten. Die Wiederverwendung oder Wiederaufbereitung kann die strukturelle Integrität des Geräts beeinträchtigen und/oder zu einem Geräteausfall führen, der wiederum Verletzungen, Erkrankungen oder den Tod des Patienten zur Folge haben kann. Außerdem besteht bei der Wiederaufbereitung von Einmalprodukten die Gefahr einer Kontamination und/oder einer Infektion des Patienten oder einer Kreuzinfektion, einschließlich, aber nicht beschränkt auf die Übertragung von Infektionskrankheiten von einem Patienten auf einen anderen. Eine Kontamination des Produkts kann zu Verletzungen, Erkrankungen oder zum Tod des Patienten führen. Siehe die zusätzlichen "Vorsichtsmaßnahmen" in dieser Gebrauchsanweisung.
Vorsichtsmaßnahmen
- Die Sicherheit und Wirksamkeit von Progel Platinum™ wurde bei Patienten mit den folgenden Bedingungen nicht nachgewiesen:
- Unter 18 Jahre alt, schwangere oder stillende Frauen.
- Kontaminierte oder verschmutzte Lungenresektionsfälle.
- Das Vorhandensein einer aktiven Infektion.
- Bei Vorhandensein anderer Versiegelungsmittel, hämostatischer Vorrichtungen oder anderer Produkte als Nähte und Klammern, die beim standardmäßigen viszeralen Pleuraverschluss verwendet werden.
- Viszerales Pleura-Leck aufgrund eines Spontanpneumothorax, eines nicht-resektiven Traumas des Lungengewebes oder eines malignen Tumors sowie eines angeborenen oder erworbenen funktionellen oder anatomischen Defekts.
- In jedem anderen Bereich oder Gewebe als der viszeralen Pleuraoberfläche wie angegeben.
- Die Verwendung von Progel Platinum™ mit einem Zusatzstoff (z. B. Antibiotika) zu einer Komponente wurde nicht untersucht.
- Die Sterilverpackung und die Versiegelung vor der Anwendung überprüfen. Nicht verwenden, wenn Sterilverpackung oder Siegel beschädigt oder offen sind.
- Verwenden Sie den rehydrierten Vernetzer nicht nach 20 Minuten, da die Leistung von Progel Platinum™ beeinträchtigt werden kann.
- Eine Unterbrechung der Anwendung für etwa 10 Sekunden kann zu einer Verstopfung der Sprühspitze führen. Wenn es zu einer Verstopfung kommt, entfernen Sie die Sprühspitze, wischen Sie das Ende des Applikators ab, um jegliche Flüssigkeit zu entfernen, und stecken Sie eine neue Sprühspitze (mitgeliefert) auf das Ende des Applikators.
- Progel Platinum™ ist nur für den einmaligen Gebrauch bestimmt. Die Komponenten dürfen nicht erneut sterilisiert oder wiederverwendet werden. Die erneute Sterilisation oder Wiederverwendung von Progel Platinum™ kann zu einem Verlust der funktionellen Produktleistung führen.
- Während der Anwendung von Progel Platinum™ sollte, wenn möglich, die gezielte Lungenbeatmung unterbrochen werden, um den Luftaustritt an den Zielstellen zu reduzieren und die Gewebebewegung während der Anwendung von Progel Platinum™ zu minimieren. Wenn der Patient eine gezielte Lungenventilation benötigt, wird ein reduziertes Tidalvolumen empfohlen.
- Wischen Sie während der Vorbereitung und zwischen den Sprühstößen die Applikatorspitze mit sauberer, steriler Gaze ab, um eventuelle Flüssigkeitsreste zu entfernen. Vermeiden Sie eine Vermischung der Komponenten: Wischen Sie nicht von einer Kartuschenöffnung zur anderen - wischen Sie jede Öffnung separat ab.
- Das einzigartige Design der Sprühspitze ermöglicht die Anwendung von Progel Platinum™ als Spray oder als Strahl (ein fester, gleichmäßiger Druck auf die Schubstange ergibt einen Spray, während ein leichter Druck einen Strahl ergibt).
- Halten Sie die Applikatorspitze während der Anwendung von Progel Platinum™ ca. 5 cm vom Zielbereich entfernt, um die Bildung von Blasen im Progel Platinum™ Material während der Anwendung zu vermeiden. Blasen können die Haftfähigkeit und/oder die mechanischen Eigenschaften von Progel Platinum™ beeinträchtigen.
- Entsorgen Sie unbenutztes Material entsprechend der Standardpraxis für Progel Platinum™ Komponenten.
- Rekombinantes Humanalbumin - rHA im Progel Platinum™ Kit wird aus Reis gewonnen und enthält keine menschliche oder tierische Quelle. Das rHA ist gleichwertig mit menschlichem Serumalbumin, ohne den Ursprung aus menschlichem Blut.
- Bei der Montage des Applikators ist die Progel Platinum™ Schubstange so konzipiert, dass sie im Applikatorgehäuse einrastet. Ein gewaltsames Entfernen der verriegelnden Schubstange aus dem Applikatorgehäuse kann zu einer möglichen Beschädigung des Applikatorsystems oder der Chemiekartuschen führen.
Unerwünschte Reaktionen
Wie bei allen Medizinprodukten, die bei chirurgischen Eingriffen verwendet werden, sind unerwünschte Wirkungen immer möglich. Im Folgenden werden mögliche Nebenwirkungen im Zusammenhang mit Lungenoperationen aufgeführt:
- Anämie
- Tod
- Herzprobleme
- Pleuraerguss
- Nierenversagen, akut
- Herzrhythmusstörungen
- Blutungen
- Herzinsuffizienz
- Ödeme
- Allergische Reaktion
- Dyspnoe
- Schmerzen
- Lungenentzündung
- Embolie
- Urinale Probleme
- Versagen der Atmung
- Grippeähnliche Symptome
- Blutung
- Atmungsinsuffizienz
- Hämatom
- Gastroösophagealer Reflux
- Atmungsschwierigkeiten
BD-54055