Bitte beachten Sie, dass möglicherweise nicht alle Produkte, Dienstleistungen oder Merkmale von Produkten und Dienstleistungen in Ihrer Region verfügbar sind. Bitte erkundigen Sie sich bei Ihrem BD Außendienstmitarbeiter vor Ort.
Referenzen
- Arista™ ™ AH resorbierbare hämostatische Partikel PMA P050038 Klinische Studie.
- Die vollständigen Anwendungshinweise finden Sie in der Gebrauchsanleitung.
- Arista™ ™ AH resorbierbare hämostatische Partikel Gebrauchsanleitung.
INDIKATIONEN
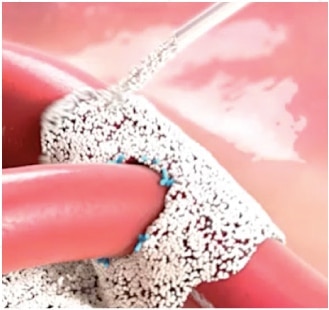
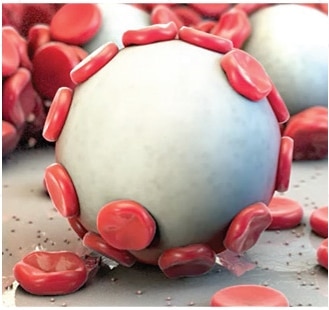
Arista™ ™ AH resorbierbare hämostatische Partikel ist für chirurgische Verfahren (mit Ausnahme von ophthalmischen Verfahren) als zusätzliches hämostatisches Hilfsmittel indiziert, wenn die Kontrolle von Kapillaren-, Venen- und Arteriolenblutungen durch Druck, Ligatur und andere herkömmliche Verfahren unwirksam oder unpraktisch ist.
KONTRAINDIKATIONEN
- Arista™ AH resorbierbare hämostatische™ Partikel nicht in Blutgefäße injizieren, da die Gefahr für Embolisierung und Tod bestehen kann.
WARNHINWEISE
- Die Sicherheit und Wirksamkeit von Arista™ AH resorbierbare hämostatische Partikel bei Kindern, schwangeren und/oder stillenden Frauen wurde nicht klinisch untersucht. Da Berichte einer verminderten Amylaseaktivität bei Neugeborenen bis zu einem Lebensalter von 10 Monaten vorliegen, kann die Absorptionsrate von Arista™ AH resorbierbare hämostatische Partikel bei dieser Bevölkerungsgruppe länger als 48 Stunden dauern.
- Sobald die Hämostase erreicht wurde, muss überschüssiges Arista™ AH resorbierbare hämostatische Partikel von der Eingriffstelle durch Spülung und Aspiration entfernt werden, insbesondere bei der Anwendung in und um Knochen-Foramina, in den Bereichen knöcherner Begrenzungen, im Rückenmark und/oder am Sehnerv und Chiasma. Arista™ AH resorbierbare hämostatische Partikel quillt unmittelbar bei Kontakt mit Blut oder anderen Flüssigkeiten auf sein maximales Volumen auf. Trockenes, weißes Arista™ AH resorbierbare hämostatische Partikel muss entfernt werden. Die Möglichkeit, dass das Produkt die normale Funktion beeinträchtigt und/oder durch Aufquellen eine Kompressionsnekrose des umliegenden Gewebes verursacht, wird durch die Entfernung des überschüssigen Trockenmaterials verringert.
- Dieses Produkt ist nur zum einmaligen Gebrauch bestimmt. Wiederverwendung, erneute Sterilisation, Wiederaufbereitung und/oder erneute Verpackung kann die grundsätzliche Material- und Designeigenschaften gefährden, die von enormer Wichtigkeit für die Gesamtleistung der Vorrichtung sind und zu Funktionsausfall der Vorrichtung führen können, was die Verletzung des Patienten als Folge haben kann. Wiederverwendung, Wiederaufbereitung, erneute Sterilisation oder Umverpackung kann auch ein Kontaminationsrisiko für das Produkt bedeuten und/oder zu Patienteninfektion oder Kreuzinfektion führen, einschließlich, aber nicht beschränkt auf, die Übertragung von infektiösen Krankheiten von einem Patienten zu einem anderen. Die Kontamination des Produkts kann zu Verletzung, Erkrankung oder Tod des Patienten oder Endbenutzers führen.
- Arista™ AH resorbierbare hämostatische Partikel ist nicht als Ersatz für eine sorgfältige Operationstechnik und die korrekte Anbringung von Ligaturen oder anderen konventionellen Verfahren für Hämostase vorgesehen.
- Die Sicherheit und Effektivität bei ophthalmischen Verfahren wurde nicht überprüft.
- Arista™ AH resorbierbare hämostatische Partikel darf nicht zur Kontrolle postpartaler Blutungen oder bei Menorrhagie eingesetzt werden.
- Arista™ AH resorbierbare hämostatische Partikel sollte bei vorliegenden Infektionen oder an kontaminierten Körperstellen mit Vorsicht angewendet werden. Wenn nach der Anwendung von Arista™ AH resorbierbare hämostatische Partikel Anzeichen einer Infektion oder eines Abszesses vorliegen, kann ein erneuter operativer Eingriff zur Drainage erforderlich sein.
- Produkt nach Gebrauch entsorgen. Dieses Produkt kann eine biologische Gefährdung darstellen. Handhabung und Entsorgung müssen nach anerkannten medizinischen Vorgehensweisen und im Einklang mit den geltenden örtlichen, landes- und bundesstaatlichen Gesetzen und Vorschriften erfolgen.
VORSICHTSMASSNAHMEN
- Nur Ärzte, die in den entsprechenden Operationstechniken qualifiziert sind, dürfen dieses Produkt benutzen.
- Die Sicherheit und Wirksamkeit für den Gebrauch bei neurologischen Verfahren wurde nicht anhand von randomisierten klinischen Studien belegt.
- Wenn Arista™ AH resorbierbare hämostatische Partikel in Verbindung mit autologen Blutgewinnungskreisläufen verwendet wird, müssen die Anweisungen zur Verabreichung im Hinblick auf die ordnungsgemäße Filtration und Zellwaschung beachtet werden.
- Arista™ AH resorbierbare hämostatische Partikel ist zur trockenen Verwendung vorgesehen. Der Kontakt mit Kochsalz- oder Antibiotikalösungen, bevor die Hämostase erreicht wurde, führt zum Verlust der hämostatischen Wirkung.
- Arista™ AH resorbierbare hämostatische Partikel wird als steriles Produkt bereitgestellt und kann nicht erneut sterilisiert werden. Ungebrauchte, offene Behälter mit Arista™ AH resorbierbare hämostatische Partikel müssen entsorgt werden.
- Bringen Sie nicht mehr als 50g Arista™ AH resorbierbare hämostatische Partikel bei Patienten mit Diabetes auf, da Berechnungen zeigen, dass Mengen von mehr als 50g die Glukosebelastung beeinflussen können.
- Arista™ AH resorbierbare hämostatische Partikel wird nicht zur primären Behandlung von Koagulationsstörungen empfohlen.
- Bei urologischen Verfahren darf Arista™ AH resorbierbare hämostatische Partikel nicht im Nierenbecken oder in den Harnleitern verbleiben, um mögliche Herde für die Calculus-Bildung zu beseitigen.
- Es wurden keine Tests im Hinblick auf die Verwendung von Arista™ AH resorbierbare hämostatische Partikel auf Knochenoberflächen vorgenommen, an die mittels Haftmittel Implantate angebracht werden sollen. Daher empfiehlt sich der Einsatz des Produkts in diesem Zusammenhang nicht.
NEBENWIRKUNGEN
In einer randomisierten, prospektiven, gleichzeitig kontrollierten klinischen Studie wurden 288 zufällig ausgewählte Patienten mit Arista™ AH resorbierbare hämostatische Partikel oder™ dem Kontrollprodukt (Gelatineschwamm mit oder ohne Thrombin) behandelt. Die am häufigsten protokollierten Nebenwirkungen waren Schmerzen in Verbindung mit dem Eingriff, Anämie, Übelkeit und Laborwerte außerhalb des Normbereichs. Im Folgenden finden Sie eine vollständige Liste mit allen Nebenwirkungen, die mit einer Häufigkeit von mehr als 5 % bei Patienten aufgetreten sind, die mit Arista™ AH resorbierbare hämostatische Partikel™ behandelt wurden. Zum Vergleich wurden die zugehörigen unerwünschten Ereignissen der Kontrollgruppe aufgelistet. Keine der unerwünschten Ereignissen, die aufgetreten sind, wurden durch das Data Safety Monitoring Board der Verwendung von Arista™ AH resorbierbare hämostatische Partikel™ zugeschrieben.
Die Produktetiketten und Packungsbeilagen enthalten Angaben zu Indikationen, Kontraindikationen, Gefahren, Warnhinweisen, Vorsichtsmaßnahmen und eine Gebrauchsanleitung.
BD-51218