Lutonix™ RX Drug Coated Balloonは、バルーン表面にパクリタキセルを含むコーティング剤を塗布し、バルーンの拡張により血管を機械的に拡張するとともに、薬剤コーティングに含まれるパクリタキセルが血管壁に放出され、新生内膜の過形成を抑制することにより、血管の再狭窄を軽減します。
- 概要
- 特長
- 臨床データ
- 製品・アクセサリ
- 関連情報
Lutonix™ RX DCBは、大腿膝窩動脈の自家血管内における、対照血管径4 mm 以上6 mm 以下、長さ30 cm 以下の新規またはISRを含む再狭窄病変を適応範囲としています。
(2024年4月1日現在)
販売名:Lutonix ドラッグコーティングバルーンカテーテル( 大腿膝窩動脈用)
医療機器承認番号:22900BZX00252000
製造販売元:株式会社メディコン
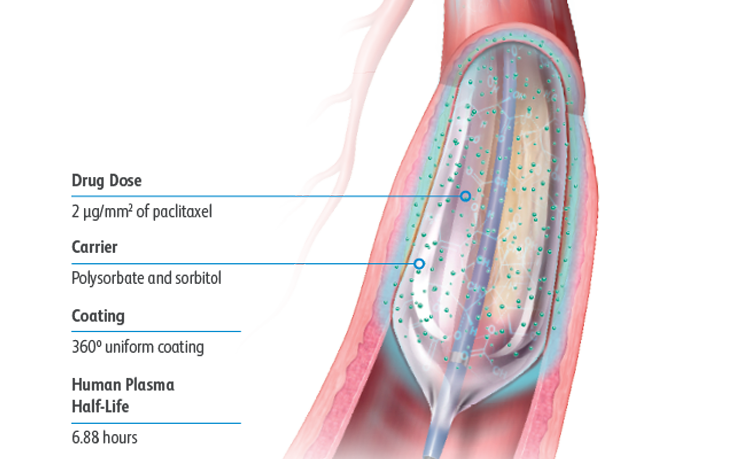
Lutonix™ DCBは、安全性と有効性の最適なバランスを追及し、2 μg/mm2 の薬剤用量とポリソルベートとソルビトールを組み合わせた担体をコーティング剤として採用し、薬剤が血管壁にスムースに移行するよう設計しています。
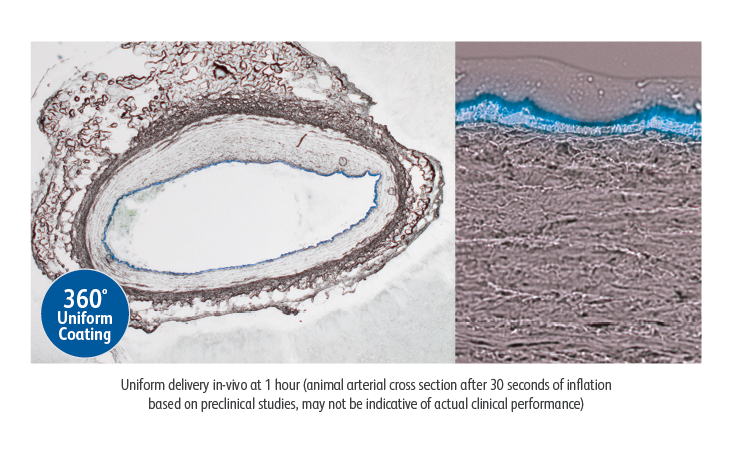
Lutonix™ DCBの薬剤コーティングは前臨床試験において、血管全周に渡る薬剤塗布を6.46 μm以下のコーティング厚で実現しています。1

Lutonix™ DCBの薬剤コーティングは以下の目的を達成するように設計しました。
- lバルーン拡張時に薬剤が血管壁に速やかに取り込まれるようにする。
- l薬剤が血管壁に対して均一に塗布されるようにする。
- l医療スタッフや患者さんの薬物ばく露量を最小限に抑えるようにする。
またLutonix™ DCB は、ドライ状態におけるシェイク試験で、の薬物損失が0.1%未満に留まることを示しました。2
CVPath Institute におけるRenu Virmani 博士らの研究チームは、前臨床試験において、治療用量の1倍と4倍のパクリタキセルの効果を調査しました。
Lutonix™ DCBの薬剤は、4倍の投与量であっても、重大な遠位塞栓や下流への薬剤の影響が少ないことがデータで示されました。
またLutonix™ DCBは、動脈壁に30日間に渡ってパクリタキセルが留まり、薬理効果は90日後まで持続することを示しました。3
- ベンチテストおよび前臨床試験の社内資料ベンチテストの結果および前臨床データは、臨床成績とは異なる場合があります。また試験方法により結果は異なる場合があります。(社内データより)
- 乾燥状態におけるシェイク試験データは、バルーンの左右面を遠心分離管の側面に対して5回軽く叩いた後に平均薬剤量を測定しました(n=5)。なおベンチテストの結果は、臨床成績とは異なる場合があり、試験方法により結果は異なる場合があります。(社内データより)
- Virmani医師による前臨床試験データは臨床成績とは異なる場合があり、試験方法により結果は異なる場合があります。
Lutonix™ Global SFA リアルワールドレジストリーは、実臨床を反映した患者群において、 Lutonix™ DCBの持続的な有効性を示しました。
有効性における主要評価項目は、標的病変の再血行再建(TLR)回避率とし、結果は12ヵ月後 94.1%(Kaplan-Meier推定値)であった。また24ヵ月時の同指標における結果は 90.3% (Kaplan-Meier推定値)であり有効性継続が確認されました。1
Lutonix™ Global SFA リアルワールドレジストリーの長病変およびステント内再狭窄(ISR)のサブグループにおいて、24ヵ月後の再血行再建(TLR)回避率は、それぞれ88.2%、84.6%となり、Lutonix™ DCBの有効性は維持されていました。1
LEVANT 2 試験は、米国の42施設とヨーロッパの12 施設において実施されたLutonix™ DCBの有効性を調査するための前向き無作為比較試験で、従来の治療法であるPTAバルーンと有効性、安全性の比較をおこないました。2
LEVANT 2 試験は結果において、安全性と有効性いずれの主要評価項目も達成しました。
安全性:Lutonix™ DCBは、PTAバルーン群と同等の安全性を示しました。
有効性:Lutonix™ DCBは、12ヵ月後の一次開存率においてPTAバルーン群に対し、29.4%の改善を示しました。(Kaplan-Meier推定値)
- Lutonix™ Global SFA リアルワールドレジストリー(N=691)における安全性に関する主要評価項目は、30日後時点での標的血管における再治療、対象肢の大切断、デバイスまたは手技に関連した死亡の回避で、結果は99.4%(681/681)でした。また有効性に関する主要評価項目は、12ヵ月時点の標的血管における再治療(TLR) 回避率と定義し、結果は93.4%(605/648)でした。なお標的血管における再治療(TLR) がない生存率はKaplan-Meier推定値で94.1%でした。
(社内データより) - LEVANT 2 臨床試験(N=476) において、12ヵ月時におけるPTAバルーン群の一次開存率 56.8%に対し、Lutonix™ DCB群は73.5% の一次開存率を得ました(p=0.001)。なお一次開存率は、再狭窄の発現がないこと(DUS PSVR ≥ 2.5 および標的病変血行再建(TLR)がない)と定義しました。またPTAバルーン群では 12ヵ月後に主要な安全性イベントが発現していない比率が 81.9% であったのに対し、Lutonix™ DCB群では86.8% であり、従来治療と同等の安全性を示しました(p=0.185)。なお主要な安全性の定義は、30 日後まで手術関連死がないこと、 1年後における対象肢の切断がないこと、再治療および対象四肢の関連死がないことと定義しました。数値は Kaplan-Meier 推定値による解析結果となります。
(社内データより)














